Neutrophiles et vascularites
L’équipe explore la biologie du neutrophile qui est une cellule essentielle dans l’inflammation et dans la défense contre les bactéries. Cependant, lorsque les neutrophiles activés ne sont pas éliminés, ils peuvent détruire les tissus.
Notre équipe étudie les neutrophiles dans les maladies inflammatoires en particulier dans les vascularites auto-immunes car ils jouent un rôle pivot dans la perturbation du système immunitaire et dans la destruction des vaisseaux. L’équipe développe également des projets visant à comprendre le rôle des neutrophiles dans l’inflammation pulmonaire associée à la mucoviscidose.
Les nouveaux mécanismes de contrôle des neutrophiles que nous découvrons peuvent être importants dans d’autres maladies où les neutrophiles sont impliqués comme l’arthrite, le choc septique, le cancer et plus récemment la COVID-19.
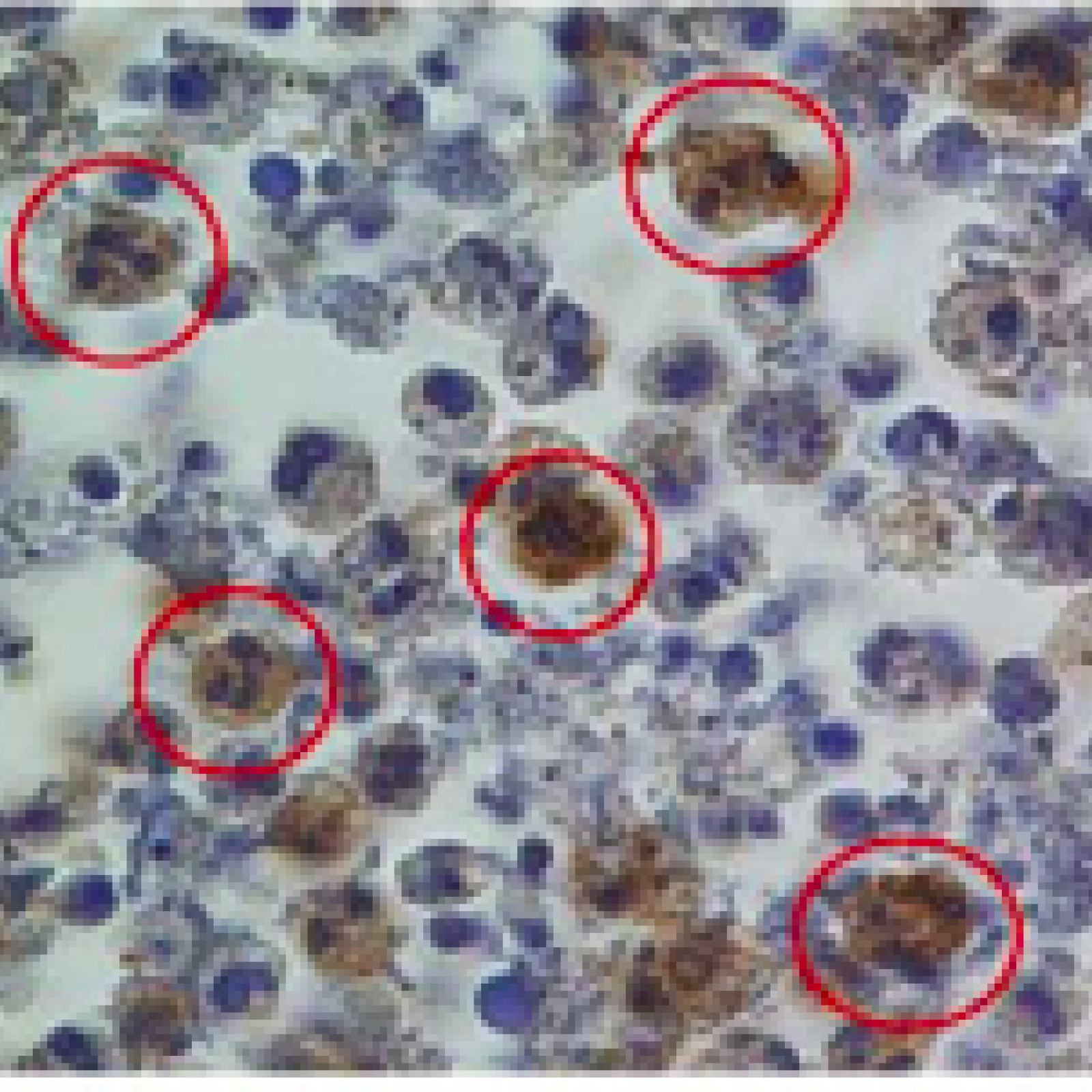
Les vascularites auto-immunes associées aux auto-anticorps dirigés contre les polynucléaires neutrophiles (appelés ANCA : anti-neutrophil cytoplasmic antibody) sont un exemple d’inflammation systémique au cours desquelles la persistance des neutrophiles activés au site inflammatoire est le signe d’un défaut de résolution de l’inflammation et entraîne la nécrose des petits vaisseaux.
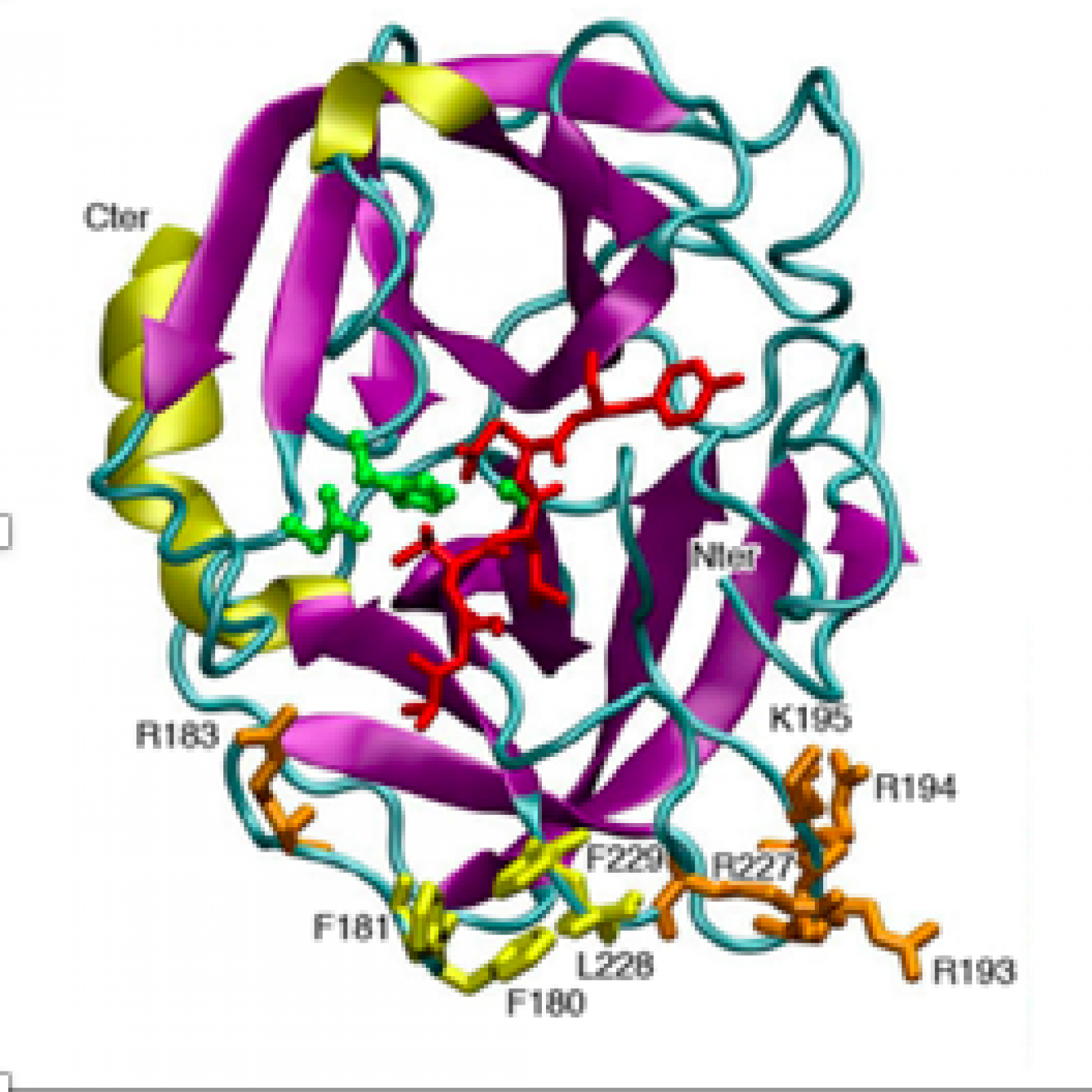
L’équipe étudie la biologie fondamentale du neutrophile afin de comprendre les mécanismes moléculaires effecteurs du neutrophile (en particulier les oxydants et les protéases) couplés aux mécanismes qui régulent ses différentes formes de mort cellulaire (Projet 1). Notre projet de recherche est également focalisé sur l’étude structurale et fonctionnelle de la protéinase 3 qui est la cible d’ANCA (Projet 3). La protéinase 3 exprimée à la surface des neutrophiles apoptotiques est considérée comme un « signal de danger » par les macrophages et perpétue l’inflammation en empêchant sa résolution. Grâce à la génération d’une souris transgénique exprimant la protéinase 3 humaine, nous proposons d’identifier les mécanismes physiopathologiques activés par la protéinase 3 lors d’inflammation dominés par les neutrophiles, comme c’est le cas dans les vascularites, la polyarthrite rhumatoïde, la mucoviscidose. (Projet 2). Les relations entre cellules immunes et cellules vasculaires (cellules endothéliales, cellules musculaires lisses vasculaires) sont également étudiées dans les mécanismes de l’inflammation et du remodelage vasculaire (Projet 4).
L’équipe bénéficie d’un recrutement de patients atteints de vascularite systémique du « Centre National de Référence des Vascularites et de la Sclérodermie Systémique » à l’hôpital Cochin. Ses étroites relations avec le service de Médecine Interne ainsi que ses connections avec les différents services cliniques de l’hôpital Cochin, en particulier le service de Pneumologie qui est Centre National de Référence pour la Mucoviscidose, pour les études des neutrophiles dans la mucoviscidose, sont un atout certain pour mener une recherche multidisciplinaire, à la fois fondamentale et translationnelle vers la clinique.