Membres du projet
Projet
Le but de nos recherches est d'élucider les mécanismes d’activation du neutrophile et le rôle de la protéinase 3 dans les vascularites systémiques autoimmunes associées à la présence d’ANCA anti-PR3.
Les vascularites nécrosantes autoimmunes affectant préférentiellement les vaisseaux de petit calibre sont généralement associées à la présence d’anticorps anti-cytoplasme de polynucléaires neutrophiles (ANCA) mais leur cause est largement inconnue. Ces vascularites systémiques constituent un groupe hétérogène de maladies définies par l’existence de lésions inflammatoires de la paroi vasculaire à l’origine de signes cliniques variables en fonction de la localisation et du calibre des vaisseaux intéressés. On distingue trois types de vascularites : la granulomatose avec polyangéite (GPA, appelée autrefois maladie de Wegener), la polyangéite microscopique (MPA) et le syndrome de Churg et Strauss (SCS). La première est associée à des ANCA anti-protéinase 3 (PR3), alors que les autres sont plus souvent associées à des ANCA anti-myéloperoxydase.
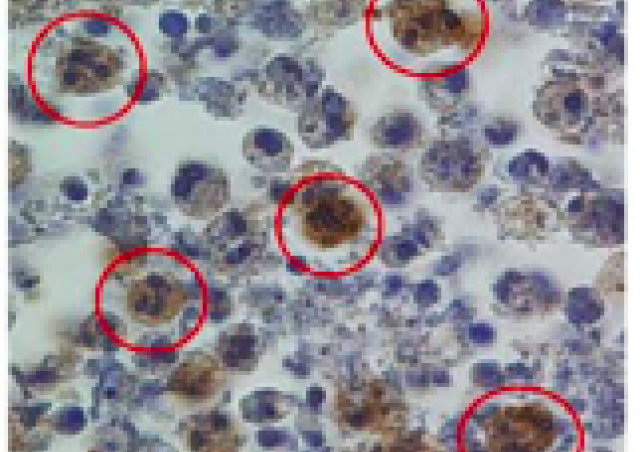
Les vascularites associées aux ANCA sont caractérisés par une inflammation systémique associée à une dysregulation immune et à une autoimmunité dont le neutrophile est une des cibles. Dans la granulomatose avec polyangéite (GPA), les neutrophiles ont une forte expression membranaire de PR3, cible des autoanticorps, ce qui constitue un facteur pro-inflammatoire. Bien que la PR3 occupe une place centrale dans la physiopathologie de cette maladie, ses fonctions sont encore mal connues. Notre projet de recherche vise à comprendre le rôle du neutrophile dans l’activation immune de la granulomatose avec polyangéite et plus spécifiquement le rôle de la PR3.
Physiopathologie des vascularites à ANCA: rôle de la protéinase 3
Il est classiquement admis, qu’au cours des vascularites, une infection va déclencher une « pré-activation des neutrophiles » résultant en une sécrétion de cytokines inflammatoires comme le TNF-alpha, une expression accrue de molécules d’adhésion. Dans ces conditions, les neutrophiles expriment des protéines granulaires à leur surface, en particulier les cibles des ANCA comme la myéloperoxydase ou la protéinase 3, qui peuvent alors lier les ANCA anti-MPO ou anti-PR3, et activer les neutrophiles. Ces derniers vont alors libérer leurs médiateurs délétères pour l’endothélium comme les oxydants et les protéases, à l’origine des lésions vasculaires. L'accumulation de neutrophiles activés et apoptotiques suggère un défaut de résolution de l'inflammation.
Nous avons montré que les neutrophiles apoptotiques de patients atteints de GPA expriment la PR3 membranaire et qu'elle est à l'origine d'un défaut de phagocytose par les macrophages et de perturbations de l'immunité innée et adaptative (Mouthon et al 2012 Presse Médicale ; Millet et al. Ann Rheum Dis. 2013).
Notre projet vise à approfondir l’étude structurale et fonctionnelle de la PR3 membranaire visant à cibler les domaines particuliers sur la protéine afin de moduler ses fonctions.
La protéinase 3 (PR3) a une structure tridimensionnelle typique des serine-protéases de la famille des chymotrypsines (Hajjar et al. FEBS J. 2010) : deux tonneaux beta composés chacun de 6 feuillets beta anti-parallèles (violet) et une hélice alpha en carboxy-terminal (jaune) (Figure 1). La triade catalytique (his71, asp118 et ser203, en vert) est localisée entre les deux tonneaux avec un substrat (rouge) positionné de façon optimale. La PR3 possède un patch hydrophobe permettant son ancrage à la membrane. Cinq acides aminés basiques (orange) permettent l’orientation correcte de la PR3 jusqu’à la surface membranaire pour lui permettre d’insérer son site hydrophobe (jaune) composé des acides aminés phe180, phe181, phe229 et L228. Le panel de droite (Figure 1) montre la PR3 insérée dans la membrane (Modelisation moléculaire en collaboration avec le groupe de Nathalie Reuter, Université de Bergen ; Hajjar et al Proteins 2008).
Ce patch hydrophobe lui permet également de se fixer sur des microvésicules circulantes exprimant la phosphatidylserine. Ainsi, ces microvésicules arborant la PR3 à leur surface peuvent jouer un rôle important dans l'inflammation et les fonctions vasculaires.

Les travaux de l’équipe ont permis de mettre en évidence la présence de la PR3 dans une plateforme protéique à la surface des neutrophiles apoptotiques. La PR3 qui est une phosphatidylserine–binding protein peut s’associer et moduler l’activité des protéines impliquées dans la reconnaissance des cellules apoptotiques : la phospholipidscramblase 1, la calreticuline, le fragment du complément C1q et l’annexine-A1. La présence de la PR3 dans cette plateforme protéique exprimée à la surface des neutrophiles apoptotiques a un effet pro-inflammatoire et subversif sur la réponse immune.

Dysfonctionnement des voies de mort dans les neutrophiles des patients atteints de vascularite
L'étude fonctionnelle des neutrophiles des patients atteints de vascularites associées aux ANCA dans le cadre de l'étude NEUTRO-VASC (PH-RC national dirigé par Luc Mouthon) a été réalisée afin de proposer si le neutrophile pouvait servir de nouveau biomarqueur dans ces maladies.
L’analyse protéomique des neutrophiles réalisée chez plus de 70 patients atteints de GPA a permis de montrer que les neutrophiles de patients ont un dérèglement intrinsèque dans les voies de mort et dans les mécanismes qui permettent la reconnaissance des neutrophiles apoptotiques qui permettent la résolution de l’inflammation.
Un réseau de protéines membranaires contenant l’autoantigène protéinase 3, l’annexine-A1 et la phospholipidscramblase1 a été mis en évidence à la surface des neutrophiles apoptotiques de patients qui présentaient une atteinte rénale.


Analyse de la dysrégulation immunitaire dans les vascularites
Les vascularites associées aux ANCA sont caractérisés par une inflammation systémique associée à une dysregulation immune et à une autoimmunité dont le neutrophile est une des cibles
A ce jour, on ne connaît pas la cause de cette maladie. Notre projet de recherche vise à comprendre le rôle du neutrophile dans l’activation immune de la granulomatose avec polyangéite et plus spécifiquement le rôle de la PR3.
En 2015, l'équipe a découvert un nouveau mécanisme par lequel l'autoantigène PR3 peut initier une cascade inflammatoire. Cette étude montre pour la première fois que les vascularites autoimmunes auraient une composante auto-inflammatoire dépendante de l'interleukine 1.
Dans les vascularites, les neutrophiles sont activés par les ANCA et sont apoptotiques. Ils expriment alors la PR3 à leur surface qui peut interférer avec la phagocytose par les macrophages (Kantari et al Blood 2007) et les activer (Gabillet et al J Immunol 2012). Cette activation implique la voie MYD88/interleukine 1 et déclenche la production de cytokines et de chimiokines inflammatoires. La PR3 est perçue comme un signal de danger par les macrophages aboutisant à la création d'un microenvironnement qui favorise l'activation des cellules dendritiques plasmacytoïdes, cellules clés dans la tolérance immunitaire associée à la phagocytose des cellules apoptotiques. Il en résulte une inhibition de la génération des lymphocytes T régulateurs et une polarisation des lymphocytes T CD4 vers un profil Th9. De plus, l'addition d'ANCA anti-PR3 favorise la génération de lymphocytes T CD4 vers un profil Th17, maintenant un état inflammatoire.