Membres du projet
Projet
On sait aujourd’hui que le neutrophile est impliqué dans de nombreuses pathologies non infectieuses au cours desquelles le neutrophile était parfaitement ignoré, comme le cancer, les maladies autoimmunes, cardiovasculaires ou allergiques.
Au cours de la dernière décennie, le neutrophile a vu son image se métamorphoser. De nouveaux concepts sont apparus :
- il est devenu une cellule douée de plasticité avec l’apparition de sous-populations de neutrophiles ayant des fonctions immunomodulatrices
- capable de migration dite « inverse »
- très sociable avec une grande capacité à dialoguer avec les autres cellules immunes
- ayant des programmes de mort cellulaires complexes et régulés (Figure 1).


Il est maintenant acquis qu’il existe un lien étroit entre les voies de mort cellulaire activées dans le neutrophile et l’inflammation.
Historiquement, les neutrophiles ont été considérés uniquement pour leur fonction de phagocytose et de destruction des bactéries. Au site de l’infection, les neutrophiles vont phagocyter puis, dans le cas le plus favorable, détruire l’agent pathogène grâce à leurs médiateurs bactéricides, en particulier les espèces réactives de l’oxygène, les protéases et les protéines antibiotiques.
Lorsque sa mission est terminée, le neutrophile activé ou non peut mourir selon différentes formes de mort, programmée ou non, en fonction du contexte (Witko-Sarsat et al Trends Immunol 2011). Parmi celles-ci, l’apoptose est une mort cellulaire programmée et non inflammatoire qui favorise donc la résolution de l’inflammation (Kantari et al. Contrib Microbiol, 2008;Thieblemont et al Semin Immunol 2016).
A l’inverse, la nécroptose, mort induite par les récepteurs de mort lorsque l’apoptose est bloquée, est une mort inflammatoire. Elle est médiée par le nécrosome, qui est un oligomère composé de RIPK1, RIPK3 et MLKL, qui conduit à l’éclatement de la cellule. Plus récemment, la pyroptose, une autre forme de mort inflammatoire induite par les inflammasomes, a été découverte. Les mécanismes conduisant à l’activation de l’inflammasome NLRP3 et à la sécrétion d’IL-1beta ont été largement étudiés dans les monocytes/macrophages mais très peu dans les neutrophiles qui semblent avoir des voies spécifiques d’activation de l’inflammasome (Figure 2).
FADD : un régulateur de l’apoptose mais aussi d’autres voies de mort
Le rôle de la protéine FADD est bien connu dans les voies de l’apoptose mais n’est pas limité à la seule transmission de signaux apoptotiques ; elle est impliquée dans la grande majorité des voies de mort décrites à ce jour. De plus, elle est essentielle au cours de nombreux processus biologiques tels que l'embryogenèse, la survie, prolifération, progression dans le cycle cellulaire, l'autophagie, l'immunité innée, la régulation de l’inflammation et le cancer (Tourneur et al. Medical Immunol 2005; Tourneur and Chiocchia. Trends Immunol 2010; Vilmont et al. Rheumatology 2012; Mouasni and Tourneur. Trends Immunol 2018).

Dans une étude récente, le groupe de Léa Tourneur a montré que FADD était sécrété dans des microvésicules dérivées de la membrane plasmique et que cette sécrétion était associée aux poussées inflammatoires dans la polyarthrite rhumatoïde.

PCNA (Proliferating Cell Nuclear Antigen) : un acteur inattendu dans l’apoptose du neutrophile
PCNA a été décrite comme une protéine nucléaire dont la structure trimérique est conservée dans l’évolution. PCNA sert de plateforme pour coordonner ces processus complexes de la réplication et la réparation de l’ADN. Dans le neutrophile, cellule dépourvue de capacité proliférative, PCNA a une localisation exclusivement cytosolique.
Dans les neutrophiles, PCNA est une protéine trimérique (en bleu) qui peut s'associer à de nombreuses protéines pour former une plateforme protéique. A l'instar de PCNA nucléaire, PCNA cytoplasmique s'adapte à la physiologie du neutrophile et favorise sa survie.
En condition basale, en l'absence d'infection ou d'inflammation, PCNA est associé à des partenaires comme les procaspases pour éviter son apoptose spontanée. 2) En condition de survie induite (inflammation, traitement par du G-CSF, anoxie) de nouveaux partenaires de PCNA (comme la protéine p21/waf1) vont s'associer et moduler la plateforme protéique pour promouvoir la survie du neutrophile. 3) Au cours de l'apoptose physiologique du neutrophile, PCNA est dégradé par le protéasome permettant la libération des procaspases. 4) La survie du neutrophile après la phagocytose d'une bactérie est également modulée par PCNA. Cette modulation est dépendante du type de bactérie


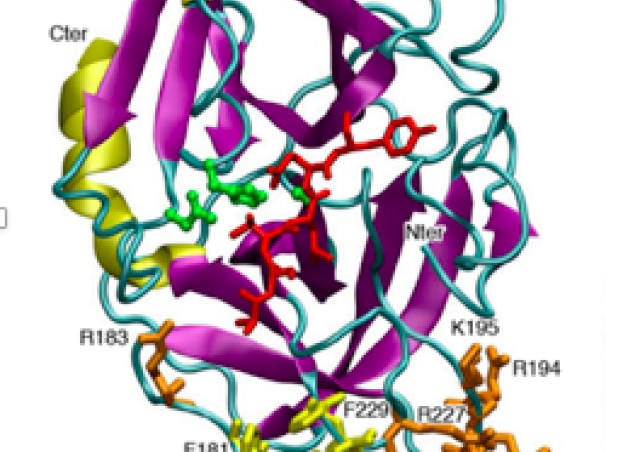
PCNA est un nouveau régulateur de la NADPH oxydase
Nos derniers travaux ont permis de montrer le PCNA est une clé essentielle dans le contrôle de la NADPH oxydase via son association spécifique avec la protéine p47phox (Ohayon et al J Exp Med 2019). Ces travaux ont permis de faire la preuve de concept que l’inhibition de PCNA dans le neutrophile pouvait avoir un effet thérapeutique anti-inflammatoire puissant en particulier dans un modèle de colite.
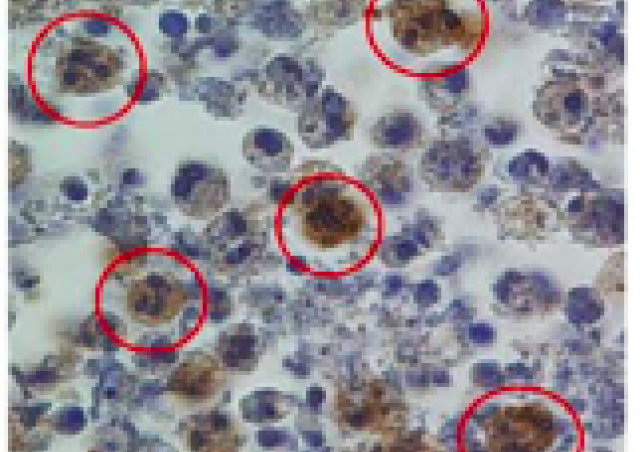
PCNA : marqueur de résistance à la chimiothérapie dans les cellules leucémiques
Nous avons montré que la localisation exclusivement cytosolique de PCNA dans les neutrophiles résulte d'un mécanisme actif d'export sous la dépendance de l'exportine CRM-1. Nous avons identifié la séquence NES dans PCNA, située à l'intérieur du trimère et active uniquement lorsque PCNA est monomérique (Bouayad et al J Biol Chem 2012; De Chiara et al J Leukocyte Biol 2013).
Nous avons observé que la présence de PCNA cytoplasmique dans les cellules HL60 résistantes à la daunorubicine favorisait leur survie et pourrait constituer une nouvelle cible thérapeutique ou un biomarqueur de la réponse aux traitements.