Les membres de l'équipe

Projet
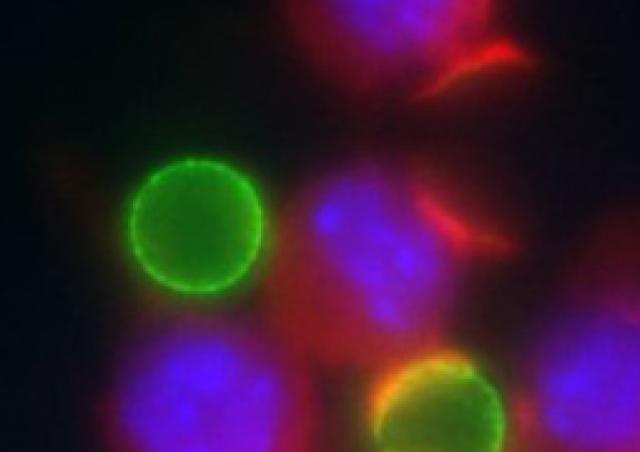
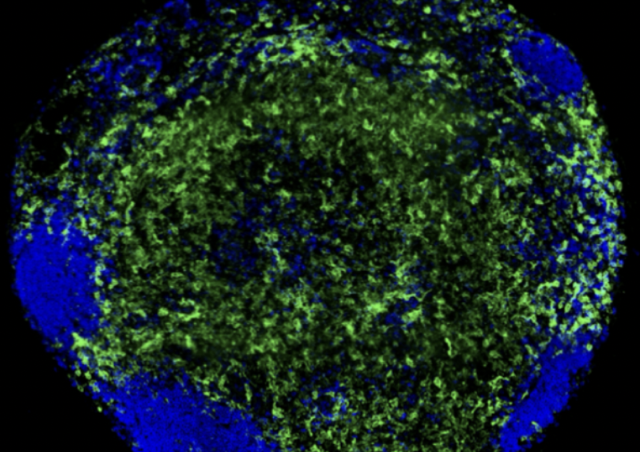
Les macrophages alvéolaires sont les cellules de l’immunité innée les plus abondantes trouvées dans les voies respiratoire, qui jouent un rôle crucial dans l’homéostasie de ces dernières. Les cellules épithéliales pulmonaires secrètent des cytokines et expriment des récepteurs qui vont moduler l’activation du macrophage alvéolaire. Cette interaction permet de maintenir le macrophage alvéolaire dans un état anti-inflammatoire à l’homéostasie. Néanmoins, suite à l’infection de l’épithélium par des virus respiratoires comme le virus de la grippe ou les rhinovirus humains (RVH), bien que les cellules épithéliales favorisent l’activation du macrophage alvéolaire, dans certaines circonstances elles peuvent aussi participer au dommage tissulaire (Villeret et al, 2020) et au dysfonctionnement du macrophage.
Nous allons utiliser des modèles in vitro et in vivo de grippe (Sanchez-Guzman et al., 2019, Villeret et al., 2018) pour étudier les interactions entre les cellules épithéliales infectées et les macrophages alvéolaires et afin de développer des nouvelles stratégies thérapeutiques qui cibleront l’amélioration des foncions du macrophage alvéolaire. Notamment, nous allons développer des stratégies vaccinales contre la grippe par voie respiratoire (Sanchez-Guzman et al., 2019, Prince et al., 2023) qui vont cibler l’épithélium respiratoire avec des adjuvants adaptés. Le choix de l’adjuvant est important pour essayer de développer une mémoire immunitaire innée au niveau pulmonaire, qui permettra d’établir une réponse immunitaire plus efficace contre le virus de la grippe ou un autre agent infectieux.
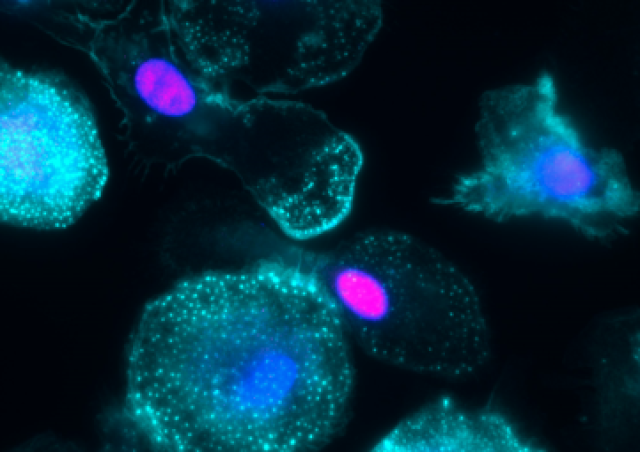
Lors de maladies inflammatoires chroniques tel que l’asthme ou la broncho-pneumopathie chronique obstructive (BPCO), les macrophages alvéolaires présentent un défaut de capacités d’élimination des pathogènes, qui est souvent exacerbé par l’infection par les RVH (Jubrail et al. 2017). Nous analysons les mécanismes conduisant à ces défauts de phagocytose en collaboration avec Astra Zeneca et Pierre-Regis Burgel (Hôpital Cochin). Nous avons observé que la réponse cytokinique est modifiée lorsque les macrophages sont infectés par le RVH et sont exposés à des produits bactériens (Jubrail et al., 2018). Nous avons identifié la protéine Arpin comme étant la cible des RVH, expliquant le défaut de phagocytose lors de la capture des bactéries par les macrophages (Jubrail et al., 2020). Nous avons montré que la capacité de dégradation des bactéries et la maturation des phagosomes est inhibés par le RVH par un mécanisme dépendant la petite GTPase ARL5b (Faure-Dupuy*, Jubrail*, et al. 2024). L'expression d'ARL5b est régulé par l'axe ICAM-1-PKR-ATF2 dans les macrophages (Faure-Dupuy, et al. 2024). La reprogrammation des macrophages induits par le virus sont en cours d’investigation. Une analyse transcriptomique de macrophages traités au RVH nous permet d’identifier de nouvelles cibles virales, ouvrant de nouvelles voies pour des stratégies thérapeutiques potentielles.
Références
- Prince, L., Martín-Faivre, L., Villeret, B., Sanchez-Guzman, D., Le Guen, P., Sallenave, J.M., Garcia-Verdugo, I. (2023) Eosinophils Recruited during Pulmonary Vaccination Regulate Mucosal Antibody Production. Am J Respir Cell Mol Biol.68:186-200.
- Villeret, B., Solhonne, B., Straube, M., Lemaire, F., Cazes, A., Garcia-Verdugo, I., Sallenave, J.M. (2020) Influenza A Virus Pre-Infection Exacerbates Pseudomonas aeruginosa-Mediated Lung Damage Through Increased MMP-9 Expression, Decreased Elafin Production and Tissue Resilience. Front Immunol.11:117.
- Sanchez-Guzman, D., Le Guen, P., Villeret, B., Sola, N., Le Borgne, R., Guyard, A., Kemmel, A., Crestani, B., Sallenave, J.M., Garcia-Verdugo, I. (2019). Silver nanoparticle-adjuvanted vaccine protects against lethal influenza infection through inducing BALT and IgA-mediated mucosal immunity. Biomaterials. 217:119308.
- Villeret, B., Dieu ,A., Straube, M., Solhonne, B., Miklavc, P., Hamadi, S., Le Borgne, R., Mailleux, A., Norel, X., Aerts, J., Diallo, D., Rouzet, F., Dietl, P., Sallenave, J.M., Garcia-Verdugo, I. (2018) Silver Nanoparticles Impair Retinoic Acid-Inducible Gene I-Mediated Mitochondrial Antiviral Immunity by Blocking the Autophagic Flux in Lung Epithelial Cells. ACS Nano.12:1188-1202.
- Jubrail, J., Kurian, N., and Niedergang, F. (2017). Macrophage phagocytosis cracking the defect code in COPD. Biomed J 40, 305-312.
- Jubrail, J., Africano-Gomez, K., Herit, F., Baturcam, E., Mayer, G., Cunoosamy, D.M., Kurian, N., and Niedergang, F. (2018). HRV16 impairs macrophages cytokine response to a secondary bacterial trigger. Front. Immunol. 9 :2908.
- Jubrail, J., Africano-Gomez, K., Herit, F., Mularski, A., Bourdoncle, P., Oberg, L., Israelsson, E., Burgel, P.R., Mayer, G., Cunoosamy, D.M., Kurian, N., and Niedergang, F. (2020). Arpin is critical for phagocytosis in macrophages and is targeted by human rhinovirus. EMBO Rep 21, e47963.
- Faure-Dupuy, S.*, Jubrail., J.*, Depierre, M., Africano-Gomez, K., Öber, L., Israelsson, E., Thôrn, K., Delevoye, C., Castellano, F., Herit, F., Guilbert, T., Russell, D.G., Mayer, G., Cunoosamy, D.M., Kurian, N., Niedergang, F. (2024). ARL5b inhibits human rhinovirus 16 propagation and impairs macrophage-mediated bacterial clearance. EMBO Rep. 2024 Mar;25(3):1156-1175.
- Faure-Dupuy, S., Depierre, M., Fremont-Debaene, Z., Herit, F., Niedergang, F. (2024). Human rhinovirus 16 induces an ICAM-1-PKT-ATF2 axis to modulate macrophages functions. J Virol. Oct 22; 98(10):e10149924.