19 membres

4 doctorant.e.s

4 brevets
5 projets

83 publications
Membres de l'équipe
Projets
Florence NIEDERGANG
Suzanne FAURE-DUPUY
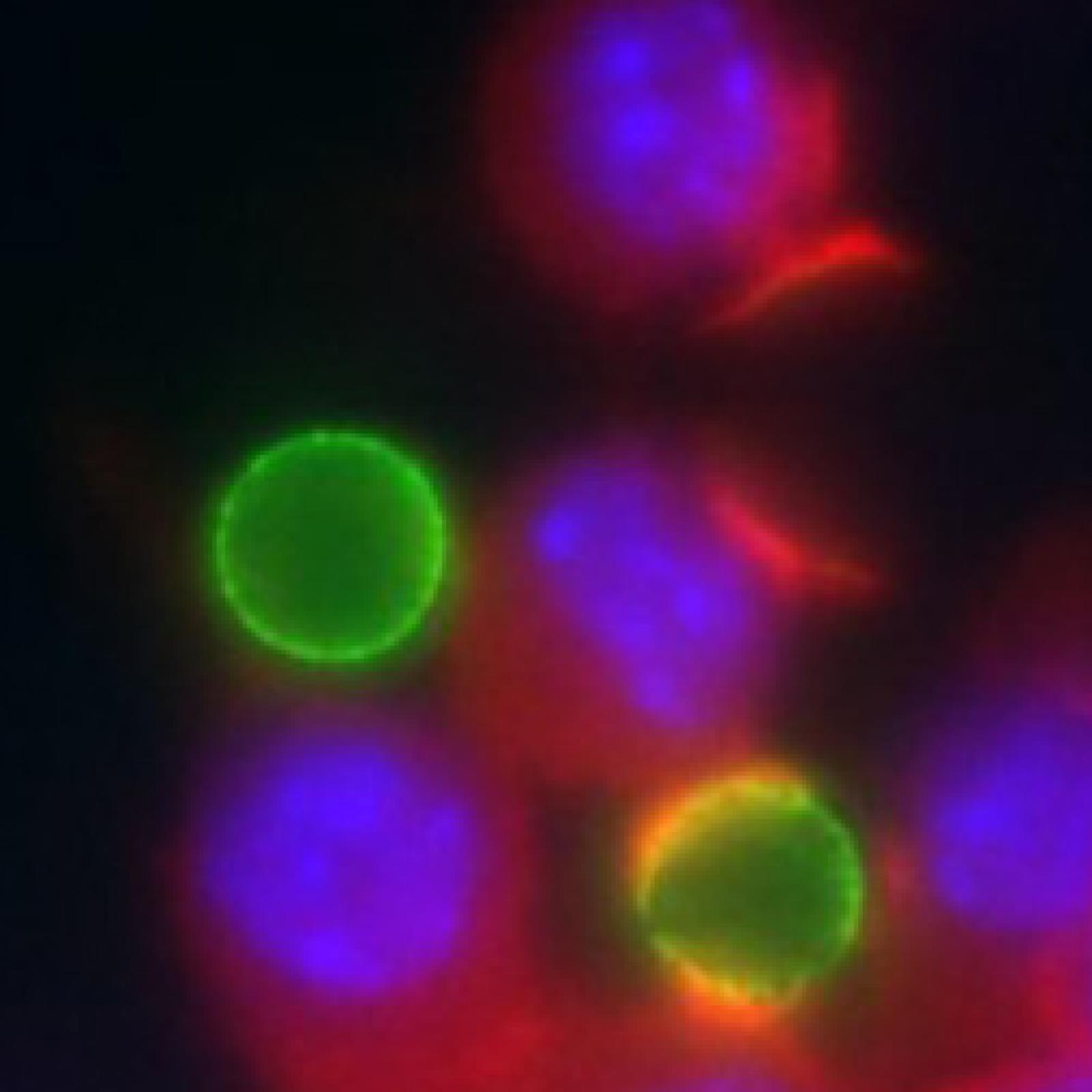
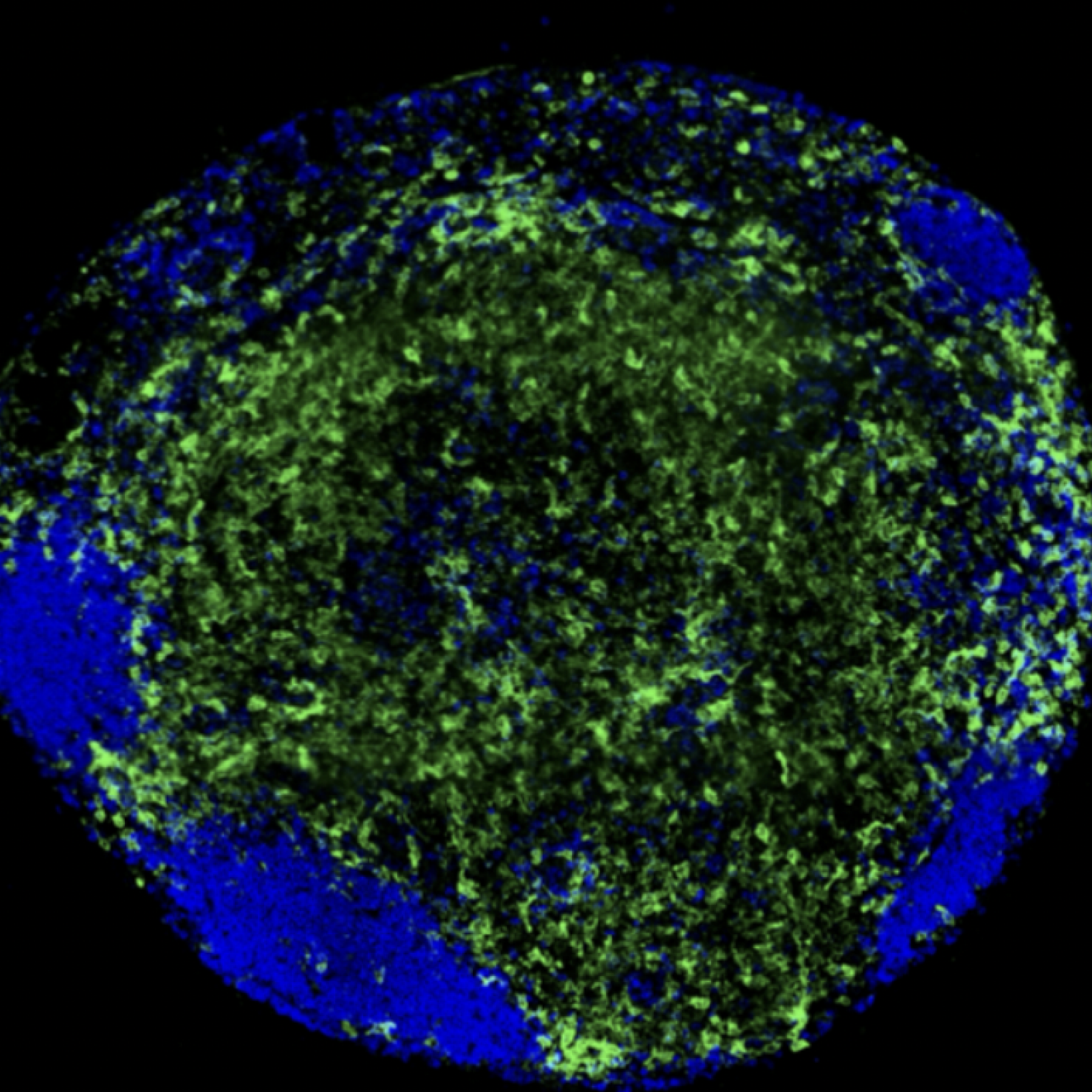
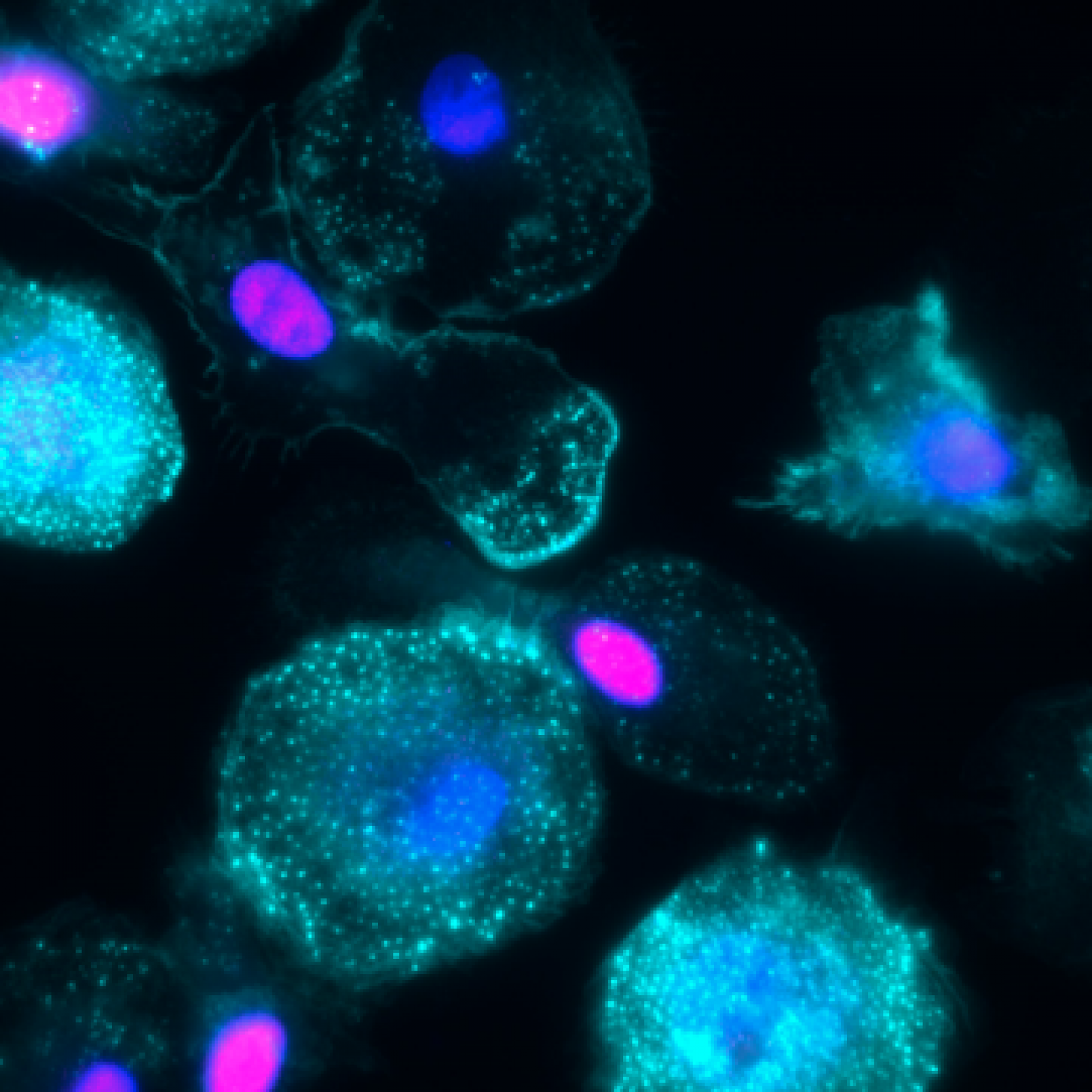
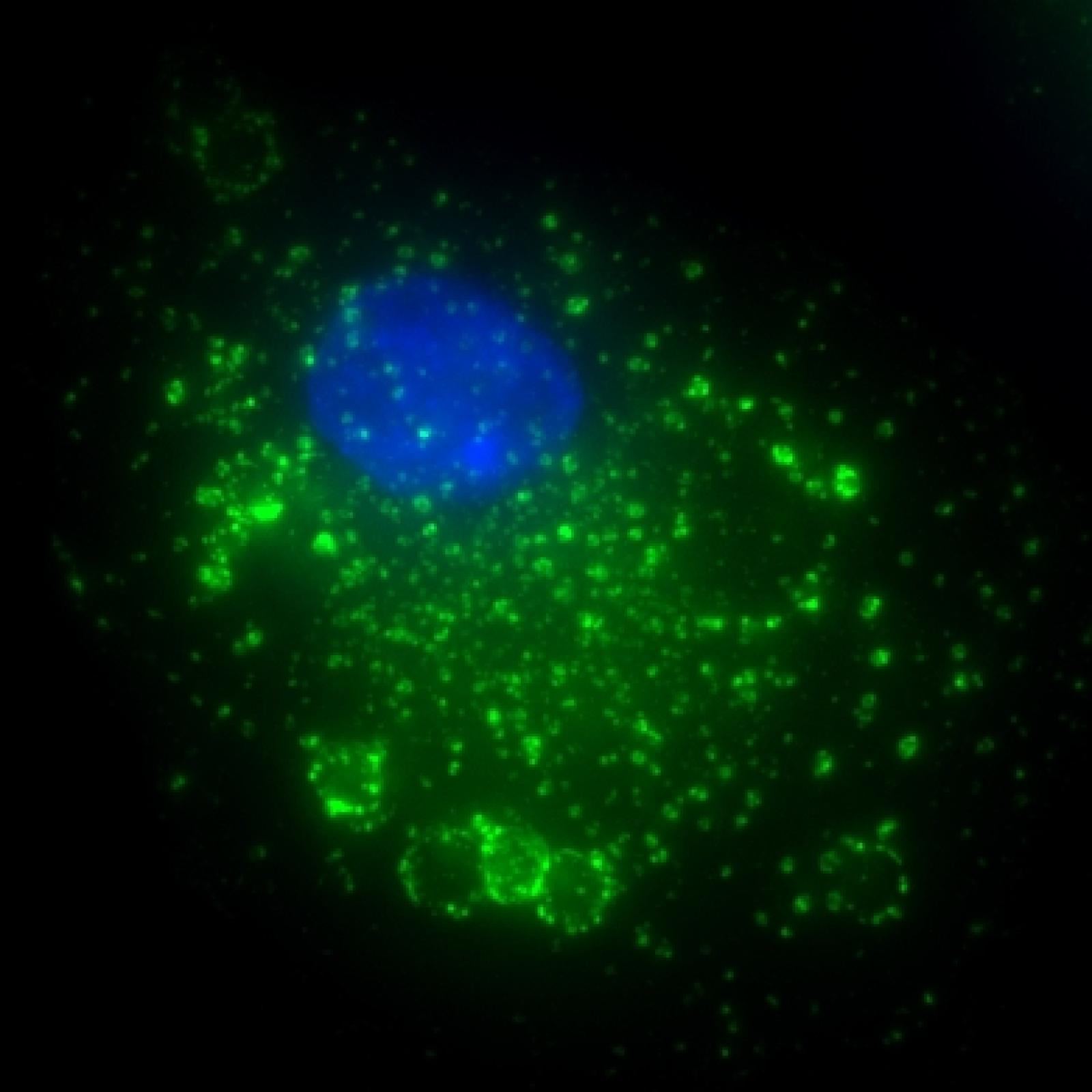
Projet 3 - Perturbations de la phagocytose et de l’activation des fonctions des macrophages par les infections virales (VIH, YFV)
Ignacio GARCIA-VERDUGO
Suzanne FAURE-DUPUY
Projet 4 - Perturbations des fonctions des macrophages par les virus respiratoires
Publications
Financements
Les dernières actualités de l'équipe
Repas d'équipe - Juin 2024

Repas d'équipe - Juin 2023

Pot de départ de Tais - Avril 2023

Repas d'équipe - Juin 2022

L'équipe à la soirée des 20 ans de l'Institut Cochin