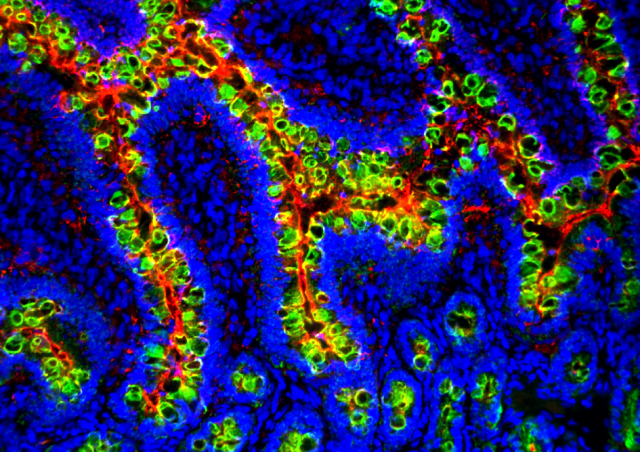
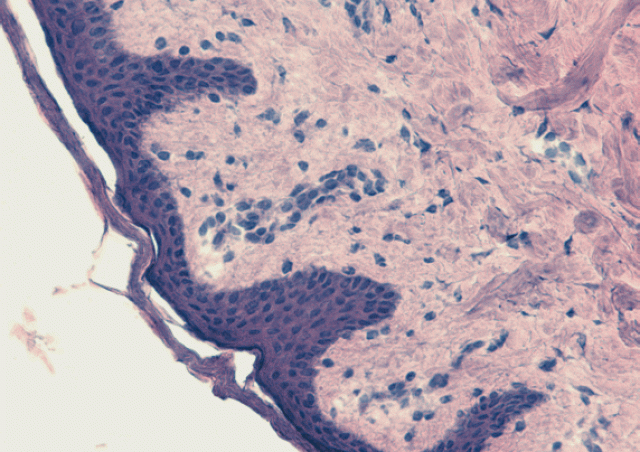
Comme dans de nombreuses infections virales, la phase aiguë de l’infection par le SARS-CoV-2 se caractérise, chez les patients symptomatiques, par une lymphopénie plus ou moins sévère. En mars 2020, en analysant les scanners thoraciques de patients hospitalisés en réanimation pour un syndrome de détresse respiratoire aiguë associé au COVID-19, les radiologues de la Clinique Ambroise Paré de Neuilly ont observé que la plupart présentaient une hyperplasie thymique. Son intensité semblait être associée à des lésions pulmonaires plus importantes mais également à un meilleur pronostic. Suite à cette observation, nous avons analysé la fonction thymique chez une vingtaine de ces patients et montré qu'elle était plus forte que celle des sujets témoins hospitalisés dans le même service de réanimation, quel que soit l'âge des patients (Cuvelier et al. 2021). En 2023, nous avons démontré que le marqueur génétique, associé à une fonction thymique plus forte chez les individus en bonne santé, était lié à des réponses immunitaires anti-SARS-CoV-2 plus fortes et plus persistantes et à une maladie pulmonaire moins grave (Roux et al. 2023).
Ces études indiquent clairement qu’une fonction thymique élevée est bénéfique chez les patients présentant une forme sévère de COVID-19, notamment chez les sujets âgés. Nous avons montré que l'étendue de l'exportation thymique chez les patients est en corrélation avec l'hyperplasie du thymus, la lymphopénie et la concentration plasmatique d'IL-7, la cytokine essentielle au développement des lymphocytes T dans le thymus et à l'homéostasie périphérique des lymphocytes T, que nous avons également identifiés comme faisant partie des signaux de danger produits rapidement lors d’infections virales des muqueuses (Beq et al. 2009 ; Ponte et al. 2017). Nos données démontrent qu'une forte capacité à produire de nouveaux lymphocytes T pendant la phase aiguë de l'infection par le SRAS-CoV-2 augmente, chez certains patients, la capacité à mettre en place une réponse immunitaire adaptative efficace et à combattre l'inflammation pulmonaire. De plus, nous avons démontré qu'un trait génétique, associé à une fonction thymique plus élevée chez les individus en bonne santé, détermine l'intensité de la réponse immunitaire anti-SARS-Cov-2 chez les patients hospitalisés pour COVID-19 sévère, avec, par conséquent, une maladie moins grave et un meilleur pronostic.
Notre expertise dans la mesure de la fonction thymique a également été mise à profit dans de nombreux projets collaboratifs en France et à l'étranger. Nous avons contribué à explorer l'importance de cette fonction chez des patients après transplantation de cellules souches hématopoïétiques, de moelle osseuse, de cœur ou de thymus, chez des sujets thymectomisés dans l'enfance, chez des enfants atteints de maladie granulomateuse chronique ou souffrant d'immunodéficience congénitale (lymphocytopénie CD4, déficit en hormone de croissance), déficit en FOXN1, syndrome de DiGeorge, maladies orphelines, etc.) et chez les patients infectés par le VIH-1 ou le VIH-2.
Membres du projet
Références
Roux HM, Marouf A, Dutrieux J, Charmeteau-De Muylder B, Figueiredo-Morgado S, Avettand-Fenoel V, Cuvelier P, Naudin C, Bouaziz F, Geri G, Couëdel-Courteille A, Squara P, Marullo S, Cheynier R. Genetically determined thymic function affects strength and duration of immune response in COVID patients with pneumonia. Sci Adv. 2023 Sep 22;9(38)
Cuvelier P, Roux H, Couëdel-Courteille A, Dutrieux J, Naudin C, Charmeteau de Muylder B, Cheynier R, Squara P, Marullo S. Protective reactive thymus hyperplasia in COVID-19 acute respiratory distress syndrome. Crit Care. 2021 Jan 4;25(1):4.
Dion ML., Bordi R., Zeidan J., Asaad R., Boulassel MR., Routy JP., Lederman MM., Sékaly RP. and Cheynier R. (2007). Slow disease progression and robust therapy-mediated CD4+ T-cell recovery are associated with efficient thymopoiesis during HIV-1 infection. Blood, 109: 2912-2920.
Cavazzana-Calvo M., Carlier F, Le Deist F., Morillon E., Taupin P., Gautier D., Radford-Weiss I., Caillat-Zucman S., Neven B., Blanche S., Cheynier R., Fischer A. and Hacein-Bey-Abina S. (2007). Long-term T cell reconstitution after haematopoietic stem cell transplantation in primary T cell immunodeficient patients is associated with myeloid chimerism and possibly the primary disease phenotype. Blood 109(10):4575-81.
Gautier D., Beq S., Cortesão C., Sousa A.E. and Cheynier R. (2007). Efficient thymopoiesis participates in the maintenance of peripheral CD4 T-cells during chronic HIV-2 infection. Journal of Virology 81: 12685-8.
Castermans E., Baron F., Willems E., Schaaf-Lafontaine N., Meuris N., Gothot A., Vanbellighen J-F., Herens C., Seidel L.,Geenen V., Cheynier R. and Beguin Y. (2008). Evidences for neo-production of T-cells by the thymus after nonmyeloablative conditioning. Haematologica, 93(2): 240-7.
Dulude G.*, Cheynier R.*, Gauchat D., Abdallah A., Kettaf N., Sékaly R.-P. and Gratton S. (2008). The magnitude of thymic output is genetically determined through controlled intrathymic precursor T cell proliferation. Journal of Immunology 181:7818-24.
Morrhaye G, Kermani H, Legros JJ, Baron F, Beguin Y, Moutschen M, Cheynier R, Martens HJ, Geenen V. (2009). Impact of growth hormone (GH) deficiency and GH replacement upon thymus function in adult patients. PLoS ONE. May 22;4(5):e5668.
Albuquerque A., Marques J., Silva S.L., Ligeiro D., Devlin B-H., Dutrieux J., Cheynier R., Pignata C., Victorino R., Markert M.L., Sousa A.E. (2012). Human FOXN1-Deficiency Is Associated with αβ Double-Negative and FoxP3+ T Cell Expansions that Are Distinctly Modulated upon Thymic Transplantation. PloS One. 7(5): e36651.
Darlington P.J., Touil T., Doucet J.S., Gaucher D., Zeidan J., Gauchat D., Corsini R., Kim H.J., Duddy M., Jalili F., Arbour N., Kebir H., Chen J., Arnold D.L., Bowman M., Antel J., Prat A., Freedman M.S., Atkins H., Sekaly R., Cheynier R., Bar-Or A.; Canadian MS/BMT Study Group. (2013) Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann Neurol. Mar;73(3):341-54.
Régent A, Autran B, Carcelain G, Cheynier R, Terrier B, Charmeteau-De Muylder B, Krivitzky A, Oksenhendler E, Costedoat-Chalumeau N, Hubert P, Lortholary O, Dupin N, Debré P, Guillevin L, Mouthon L; French Idiopathic CD4 T Lymphocytopenia Study Group. (2014) Idiopathic CD4 lymphocytopenia: clinical and immunologic characteristics and follow-up of 40 patients. Medicine (Baltimore). 2014 Mar;93(2):61-72.
Albuquerque A., S. Fernandes, R. Tendeiro, R. Cheynier, M. Lucas, S. Silva,R. Victorino and A. Sousa. (2017) Major CD4 T-cell depletion and immune senescence in a patient with Chronic Granulomatous Disease. Frontiers in Immunology, 11 May 2017.
Silva SL, Albuquerque A, Amaral AJ, Li QZ, Mota C, Cheynier R, Victorino RMM, Pereira-Santos MC, Sousa AE. (2017) Autoimmunity and allergy control in adults submitted to complete thymectomy early in infancy. PLoS One. Jul 7;12(7):e0180385.
Sannier A, Stroumza N, Caligiuri G, Le Borgne-Moynier M, Andreata F, Senemaud J, Louedec L, Even G, Gaston AT, Deschildre C, Couvelard A, Ou P, Cheynier R, Nataf P, Dorent R, Nicoletti A. (2017) Thymic function is a major determinant of onset of antibody-mediated rejection in heart transplantation. Am J Transplant. 2018 Apr;18(4):964-971.
Rb-Silva R, Nobrega C, Azevedo C, Athayde E, Canto-Gomes J, Ferreira I, Cheynier R, Yates AJ, Horta A, Correia-Neves M. (2019) Thymic Function as a Predictor of Immune Recovery in Chronically HIV-Infected Patients Initiating Antiretroviral Therapy. Front Immunol. 2019 Feb 5;10:25.
Massey J, Jackson K, Singh M, Hughes B, Withers B, Ford C, Khoo M, Hendrawan K, Zaunders J, Charmeteau-De Muylder B, Cheynier R, Luciani F, Ma D, Moore J, Sutton. I. (2022) Haematopoietic Stem Cell Transplantation Results in Extensive Remodelling of the Clonal T Cell Repertoire in Multiple Sclerosis. Front Immunol. 2022 Feb 7;13:798300. doi: 10.3389/fimmu.2022.798300.