Membres du projet
Projet
Environ un homme sur dix souffre d'infertilité résultant le plus souvent d'une spermatogenèse anormale. La cause, qu'elle soit génétique ou environnementale, reste souvent inconnue, ~50 % des infertilités masculines étant définies comme "idiopathiques". La spermatogenèse, le processus par lequel les spermatozoïdes se développent à partir de cellules germinales immatures dans les tubules séminifères du testicule, est associée à un programme génétique hautement dynamique et à des changements chromatiniens importants.
Notre groupe étudie la spermatogenèse au niveau des gènes et de la chromatine afin d'identifier et de caractériser les régulateurs/voies essentiels à la différenciation des spermatozoïdes et à la fertilité masculine. Nous nous intéressons particulièrement à la façon dont les gènes portés par les chromosomes sexuels (l’X et l’Y chez les mammifères) sont régulés dans les cellules germinales mâles ; leur dérégulation entraine en effet une infertilité masculine. Notre objectif est de produire des connaissances fondamentales sur les mécanismes moléculaires contrôlant la spermatogenèse afin de mieux comprendre les causes génétiques et épigénétiques de l'infertilité masculine.
Notre projet vise également à étudier l'épigénome des gamètes mâles en conditions physiologiques et physiopathologiques. En effet, il est désormais bien connu que, lors de la fécondation, le spermatozoïde apporte à l'embryon bien plus que son ADN : les informations épigénétiques (« code » porté par la chromatine, ARN non-codants, modifications de l'ADN) sont également transmises à l'embryon et peuvent affecter le développement embryonnaire et la santé de la descendance, en cas de dérégulation. Une meilleure caractérisation des mécanismes moléculaires contrôlant la mise en place de l’épigénome des gamètes paternels est donc essentielle.
Pour aborder ces questions, nous combinons des modèles in vivo et in vitro et utilisons des techniques de biologie moléculaire et cellulaire, de biochimie et de biologie de la reproduction. Nous effectuons en particulier des analyses (« omiques ») à grande échelle telles que la transcriptomique, l'épigénétique et la protéomique.
Sélection de références
Moretti et al. Cell Death & Diff 2017
Cocquet et al. PLoS Genet 2012
Actualités:
¤ Janvier 2025: Publication de notre article dans Communications Biology
¤ Novembre 2024: Félicitations à Julie Cocquet pour sa réussite au concours DR Inserm
¤ Novembre 2024: Bienvenue à Gabrielle Maillard notre nouvelle étudiante M2!
¤ Février 2024: Félicitations à Alberto de la Iglesia et Carina Prip-Buus pour l'obtention d'un financement PIC (Projet Inter Cochin)
¤ Octobre 2023: Félicitations à Manon Coulée pour sa soutenance de thèse et l'obtention de son doctorat en sciences
¤ Octobre 2023 : Félicitations à Alberto de la Iglesia pour l’obtention d’un financement de postdoc de 3 ans par la FRM
¤ Juin 2023: Félicitations à Manon Coulée pour l’obtention d’un financement “transition postdoc” auprès du Labex Who Am I ?
¤ Avril 2023 : Publication de notre article dans EMBO Reports

Figure issue de Moretti et al. 2017. Localisation de l'histone méthyl transférase DOT1L (vert) dans des cellules germinales mâles à différents stades de leur développement. Le DAPI (en bleu) colore les noyaux et la lectin-PNA (en rouge) marque les acrosomes.

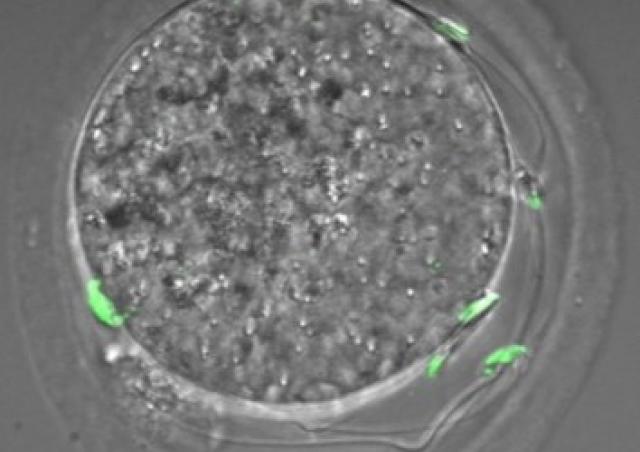
Figure issue de Cocquet et al. PLoS Genet 2012. Localisation des protéines SLX et SLY dan les spermatides. Les protéines SLX et SLY (en vert) co-localisent avec les chromosomes sexuels (X et Y, en jaune) et avec le cluster de gènes multicopies (en rouge, DNA-FISH). Le DAPI (bleu) colore les noyaux.