Membres du projet
Projet
Le streptocoque du groupe B (Streptococcus agalactiae, SGB) appartient à la flore gastro-intestinale et vaginale de 10 à 30 % des individus en bonne santé. Cette bactérie encapsulée à Gram positif peut également se transformer en un pathogène mortel chez les nouveau-nés et est reconnue comme l'une des principales causes d'infections invasives néonatales. Malgré une antibiothérapie appropriée, le fardeau mondial des infections néonatales à SGB reste important, avec jusqu'à 10% de mortalité et 30% de séquelles neurologiques chez les nourrissons survivants. On distingue deux syndromes associés aux SGB chez les nouveau-nés : le syndrome précoce (EOD), qui survient dans les 48 heures suivant la naissance dans 90 % des cas, et qui a considérablement diminué avec l'antibiothérapie, et le syndrome tardif (LOD), qui survient entre 7 et 89 jours de vie. Le tractus gastro-intestinal représente la porte d'entrée la plus probable du syndrome tardif, caractérisé par une bactériémie sans foyer et un taux élevé de méningite associée. Cependant, les circonstances menant à ce syndrome restent largement inconnues. Les données épidémiologiques mondiales ont permis de déterminer qu’un clone particulier de SGB, presque exclusivement de sérotype capsulaire III et désigné comme le clone hypervirulent CC17, est fortement associé au LOD (60 à 80 % des cas) et à la méningite (environ 80 % des cas). Le SGB CC17 exprime des protéines de surface spécifiques qui favorisent la colonisation intestinale et confèrent des capacités de translocation de la barrière hémato-encéphalique (BHE) dans des modèles animaux. De manière remarquable, ce clone est moins responsable de l'EOD et largement sous-représenté dans les maladies adultes à SGB, ce qui implique que des facteurs spécifiques de l'hôte pourraient être impliqués dans l'invasivité des SGB CC17 chez les nouveau-nés de plus de 7 jours.
Ce projet se concentre sur le franchissement de la barrière intestinale par le clone CC-17 de GBS.
Le projet se décompose en deux axes complémentaires. D’une part, nous définissons les interactions entre SGB et la barrière intestinale et, d’autre part, nous nous intéressons à l’environnement bactérien de SGB dans l’intestin.
Interactions SGB - barrière intestinale
Un aspect particulier de la vie périnatale est la très forte concentration d'hormones liées à la grossesse, en particulier l'estradiol (E2) et la progestérone (P4), à laquelle les nouveau-nés sont exposés tout au long de la grossesse. Cette exposition hormonale conduit à des concentrations circulantes néonatales à la naissance qui sont plus de 500 fois supérieures à celles d'un adulte masculin. Ces niveaux diminuent au cours des 3 premiers jours de vie pour se stabiliser pendant plusieurs mois à des concentrations encore 5 à 50 fois supérieures à celles d'un adulte. Il est intéressant de noter que les hormones sexuelles modulent la réponse immunitaire et la perméabilité des barrières cellulaires de manière dose-dépendante. Ainsi, les concentrations d'E2 et de P4 trouvées à une période donnée du développement du nouveau-né pourraient favoriser le GBS et plus particulièrement l'invasivité et la LOD du GBS CC17.
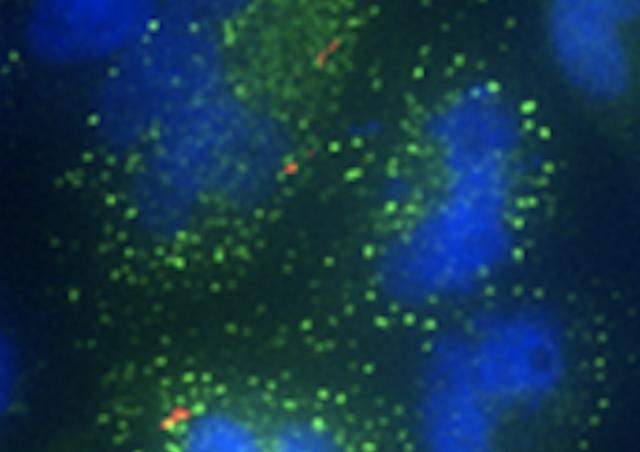
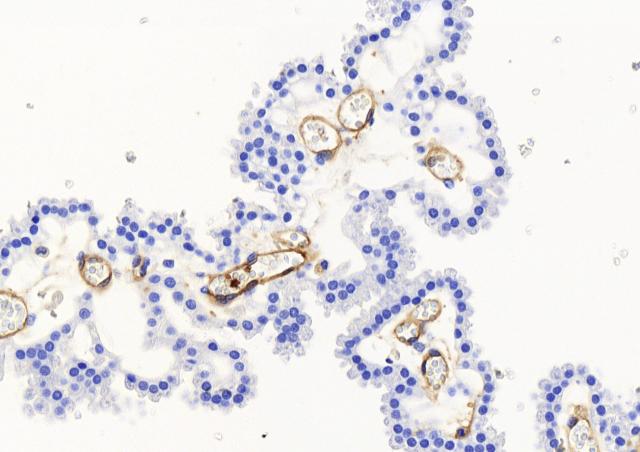
En utilisant une approche combinant des modèles murins et cellulaires d'infection avec un isolat représentatif de SGB CC17 et un autre non-CC17, tous deux de sérotype capsulaire III et responsables de maladies néonatales, nous avons démontré que l'exposition hormonale aux concentrations d'E2 et de P4 trouvées chez les nouveaux-nés de 7 jours (E2-P4 C7) favorise spécifiquement la pathogénie du SGB CC17 par rapport aux niveaux d'E2 et de P4 trouvés à la naissance (E2-P4 C0). L'invasivité accrue des SGB CC17 dans les conditions E2-P4 C7 est liée à un meilleur franchissement de la barrière intestinale par les cellules M qui est médié par la protéine de surface Srr2 spécifique aux CC17.

Métagénomique et Périnatalité
Dans le cadre de la prévention de l’infection néonatale bactérienne précoce et en particulier de l’infection néonatale à SGB, près de la moitié des femmes enceintes et des nouveau-nés reçoivent une antibioprophylaxie ou une antibiothérapie lors de l’accouchement en France et dans les pays industrialisés. Cette antibiothérapie peut avoir des conséquences à plus ou moins long terme sur l’établissement du microbiote, sa composition et le développement de l’immunité. Les objectifs de ce projet sont de déterminer par l’analyse de collections biologiques le microbiote associé à la colonisation par SGB ainsi que l’impact de paramètres environnementaux tels que l’administration d’antibiotiques et l’allaitement sur sa composition.
Nous aborderons les questions suivantes :
- Déterminer les signatures métagénomiques de la colonisation néonatale par SGB et en particulier par SGB CC-17 à 3 semaines et 2 mois de vie. Ceci permettra d’envisager de nouvelles approches préventives de l’infection néonatale tardive, notamment par une meilleure identification des nouveau-nés à risque et par la manipulation de la composition du microbiote intestinal.
- Evaluer l’impact des antibiotiques administrés pendant l’accouchement sur la flore vaginale maternelle et sur la composition et la fonction du microbiote intestinal néonatal. Des approches métagénomiques, métabolomiques et immunologiques sont utilisées pour corréler les signatures métagénomiques à diverses fonctions du microbiote.
- Identifier les communautés microbiennes vaginales associées aux complications de la grossesse et à l’infection néonatale. L’impact de la dysbiose vaginale et de la présence de pathobiontes sur la rupture prématurée des membranes chorio-amniotiques est étudié.