Membres du projet
Projet
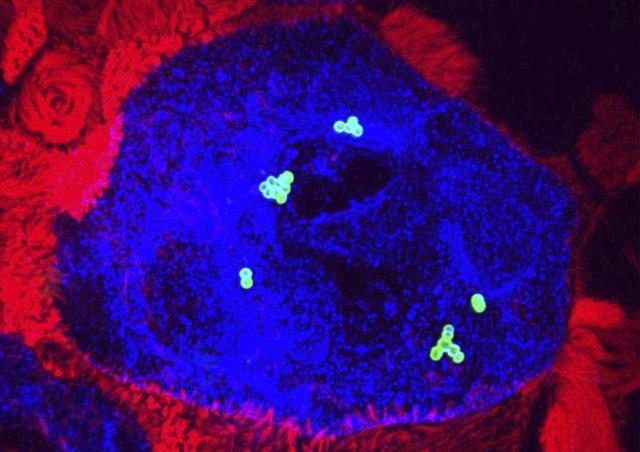
Notre laboratoire a récemment identifié l'ADP-heptose, un intermédiaire soluble de la voie de biosynthèse du lipopolysaccharide, comme un PAMP bactérien. En effet, nous avons montré que lors de l'infection par la bactérie entéroinvasive Shigella flexneri, la détection de l'ADP-heptose conduit à l'oligomérisation massive des protéines TIFA et TRAF6, à l'activation du facteur de transcription NF-kB et à l'expression de cytokines inflammatoires. De plus, nous avons montré que cette voie pro-inflammatoire est dépendante d’une kinase atypique appelée alpha-kinase 1 (ALPK1).

TIFA est une protéine adaptatrice, qui se trouve sous forme de dimères dans les cellules au repos. Elle abrite un domaine FHA connu pour se lier aux résidus thréonine et sérine phosphorylés. Au cours de l'infection, l'ADP-heptose se lie à ALPK1 et active son activité kinase. En réponse, ALPK1 phosphoryle TIFA sur la thréonine 9 (pT9). Les résidus pT9 sont reconnus par les domaines FHA d'autres dimères de TIFA, ce qui entraîne l'assemblage de larges oligomères de TIFA, appelés TIFAsomes. Outre S. flexneri, les bactéries Neisseria meningitidis, Salmonella Thyphimurium, Yersinia enterocolitica et Helicobacter pylori induisent la formation de TIFAsomes au cours de l’infection.
Notre projet utilise une approche multidisciplinaire pour établir un modèle intégré du mécanisme de détection de l'ADP-heptose et comprendre le rôle de ce nouveau PAMP dans les infections bactériennes in vivo.