Membres du projet
Projet
Le Streptocoque du Groupe B (Streptococcus agalactiae, SGB) est un commensal du tractus gastro-intestinal et vaginal retrouvé chez 10 à 30 % des adultes sains. Cette bactérie encapsulée à Gram positif est, néanmoins, un pathogène redoutable pour les nouveau-nés puisqu’il représente le principal agent responsable d'infections invasives néonatales (bactériémies et méningites principalement). Malgré des progrès considérables dans la prise en charge des patients, les méningites à SGB restent un problème de santé public avec une mortalité de 10 à 20% et des séquelles neurologiques présentes chez 25 à 50% des nouveau-nés survivants. Les données épidémiologiques mondiales ont permis d'identifier que les souches de SGB responsables d’infections chez l’Homme sont réparties entre cinq grands complexes clonaux (CC), dont un clone a été désigné hypervirulent, étant responsable d’environ 80 % des cas de méningites néonatales à SGB. Le clone hypervirulent CC17 exprime des protéines de surfaces spécifiques qui lui confèrent un tropisme méningé particulier.
L'étape critique du développement de la méningite est la transmigration des SGB du sang vers le système nerveux central (SNC). Le cerveau est normalement protégé par des barrières physiologiques qui séparent le sang du parenchyme cérébral ou du liquide céphalo-rachidien. Pour envahir le système nerveux central et provoquer une méningite, les SGB CC17 présents dans le sang doivent franchir ces barrières cérébrales. Ceci se produit après une interaction initiale entre les SGB et les cellules endothéliales ou épithéliales constituant respectivement la barrière sang-cerveau ou sang-liquide céphalorachidien. Après franchissement des barrières cérébrales, les SGB CC17 vont être au contact des différents types cellulaires présents dans le SNC, principalement les neurones et les cellules de la microglie.
Notre projet s’intéresse aux interactions hôte -pathogène lors du développement de la méningite à SGB CC17.
Notre projet se décompose en deux axes complémentaires. D’une part, nous recherchons les mécanismes impliqués dans le franchissement des barrières cérébrales et, d’autre part, nous nous intéressons au rôle des cellules gliales dans le développement de la méningite à SGB.

1-Franchissement des barrières cérébrales
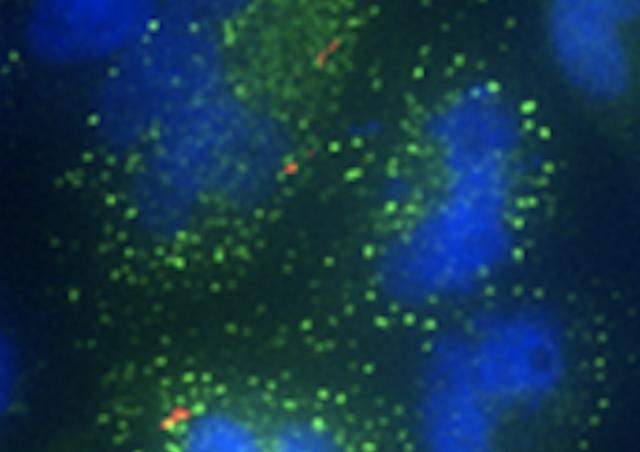
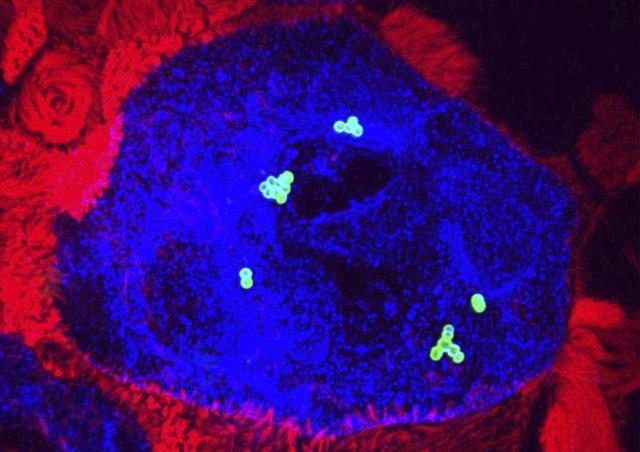
Les pathogènes à l’origine de méningites peuvent utiliser trois mécanismes non exclusifs pour franchir les barrières cérébrales. Un passage transcellulaire dans lequel les bactéries sont internalisées dans les cellules endothéliales cérébrales ou épithéliales des plexus choroïdes après reconnaissance de récepteur(s) cellulaire(s) spécifique(s) ; un passage paracellulaire dû à la désorganisation des jonctions serrées qui permet le passage des pathogènes entres les cellules ; un passage à l’aide des cellules phagocytaires appelé mécanisme du cheval de Troie correspondant à la transmigration de phagocytes infectés à travers les barrières cérébrales. Notre équipe a montré que les souches CC17 présentent des propriétés d'adhérence aux cellules endothéliales cérébrales plus élevées que les souches non-CC17. Deux adhésines de surfaces spécifiques des SGB CC17, Srr2 et HvgA, expliquent la liaison accrue des SGB CC17 aux cellules endothéliales cérébrales par rapport aux souches non-CC17 et contribuent au franchissement de la BHE dans un modèle in vivo de méningite. Nous avons récemment identifié deux récepteurs cellulaires, les intégrines α5β1 et αvβ3, comme étant des ligands de l’adhésine Srr2 qui contribuent au franchissement de la barrière hémato-encéphalique. Ces deux intégrines sont surexprimées pendant la période postnatale dans les vaisseaux cérébraux fournissant une première explication moléculaire à la susceptibilité des nouveau-nés à la méningite à SGB CC17. Notre recherche vise à identifier les sites anatomiques de transmigration du SGB CC17. Nous recherchons également lequel(s) des 3 mécanismes de transmigration possibles (transcellulaire, paracellulaire ou cheval de Troie) est mis en jeu lors l’entrée du SGB CC17 dans le SNC.
2- Rôle des cellules gliales dans les méningites néonatales à SGB
Alors que nous avons identifié des ligands bactériens des cellules endothéliales et leurs récepteurs cellulaires endothéliaux, très peu de choses sont connues sur le rôle des cellules du SNC dans le développement des méningites à SGB. Les cellules gliales sont les principales cellules constituant le SNC. L’invasion du SNC par un pathogène active le système immunitaire inné du cerveau. Bien que la réponse globale soit amorcée pour protéger le SNC, des données récentes ont montré que dans une variété de troubles neurologiques, y compris les méningites bactériennes, la neuroinflammation peut avoir un effet délétère sur le SNC en aggravant les lésions cérébrales. Les astrocytes et cellules de la microglie sont les principaux acteurs de l’immunité cérébrale. Les pieds des astrocytes jouent également un rôle prépondérant dans la régulation des fonctions vasculaires cérébrales en recouvrant la quasi-totalité des vaisseaux sanguins cérébraux. Notre objectif est d’identifier les acteurs cellulaires et moléculaires impliqués dans la réponse immunitaire innée du cerveau lors du développement des méningites à SGB ainsi que les conséquences physiopathologiques potentielles de cette réponse.