Pathogenèse bactérienne et signalisation immunitaire innée
En réponse à l'émergence de mécanismes de résistance aux antibiotiques chez de nombreuses bactéries pathogènes, il est nécessaire de développer des stratégies thérapeutiques innovantes basées sur la caractérisation de nouveaux déterminants moléculaires de la virulence et de facteurs cellulaires impliqués dans les interactions hôte-pathogène critiques pour l’infection.
Dans cette optique, les mécanismes moléculaires responsables de l’activation et de la régulation de l'immunité innée, qui constitue la première ligne de défense contre les agents pathogènes, sont particulièrement intéressants. Au cours d’une infection, les bactéries sont détectées par les récepteurs de reconnaissance des pathogènes (PRRs) des cellules immunitaires, mais aussi des cellules épithéliales et endothéliales qui agissent comme des sentinelles de l’immunité. Après reconnaissance de motifs moléculaires bactériens, les PRRs déclenchent des voies de signalisation pro-inflammatoires qui entraînent la sécrétion d'un large éventail d'effecteurs immunitaires tels que les cytokines, les chimiokines et les peptides antimicrobiens.
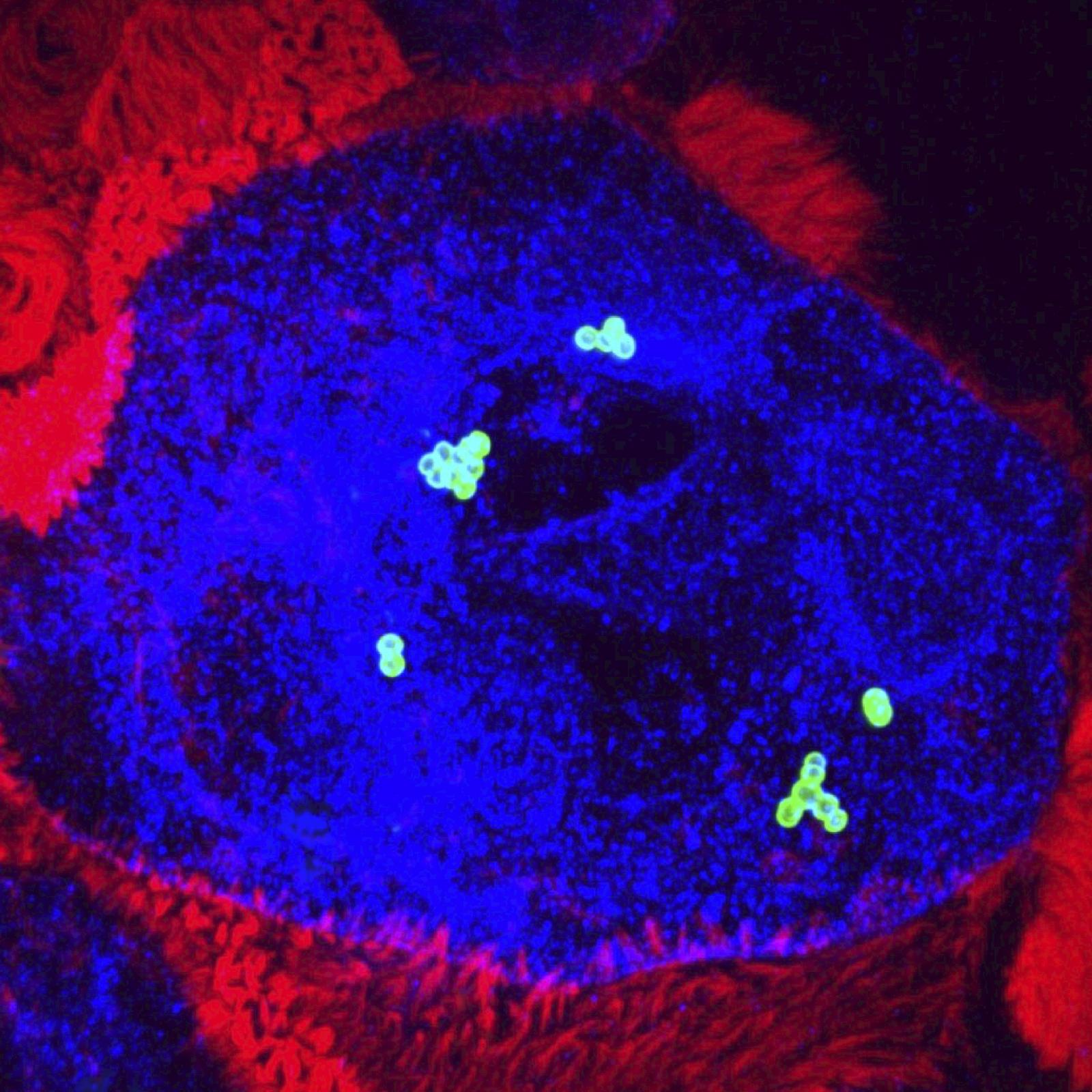
Notre équipe travaille à l'interface entre l'immunologie et la biologie cellulaire et étudie les mécanismes moléculaires impliqués dans la détection des bactéries infectieuses et le contrôle de l'immunité innée. Nous combinons les cribles d’ARN interférent, la microscopie à fluorescence sur cellules vivantes, la microscopie électronique, la protéomique et la transcriptomique pour caractériser au niveau moléculaire de nouvelles interactions hôte-pathogène susceptibles d’être ciblées par des traitements anti-infectieux. La bactérie à Gram négatif Shigella flexneri est une de nos principaux modèles d'infection.
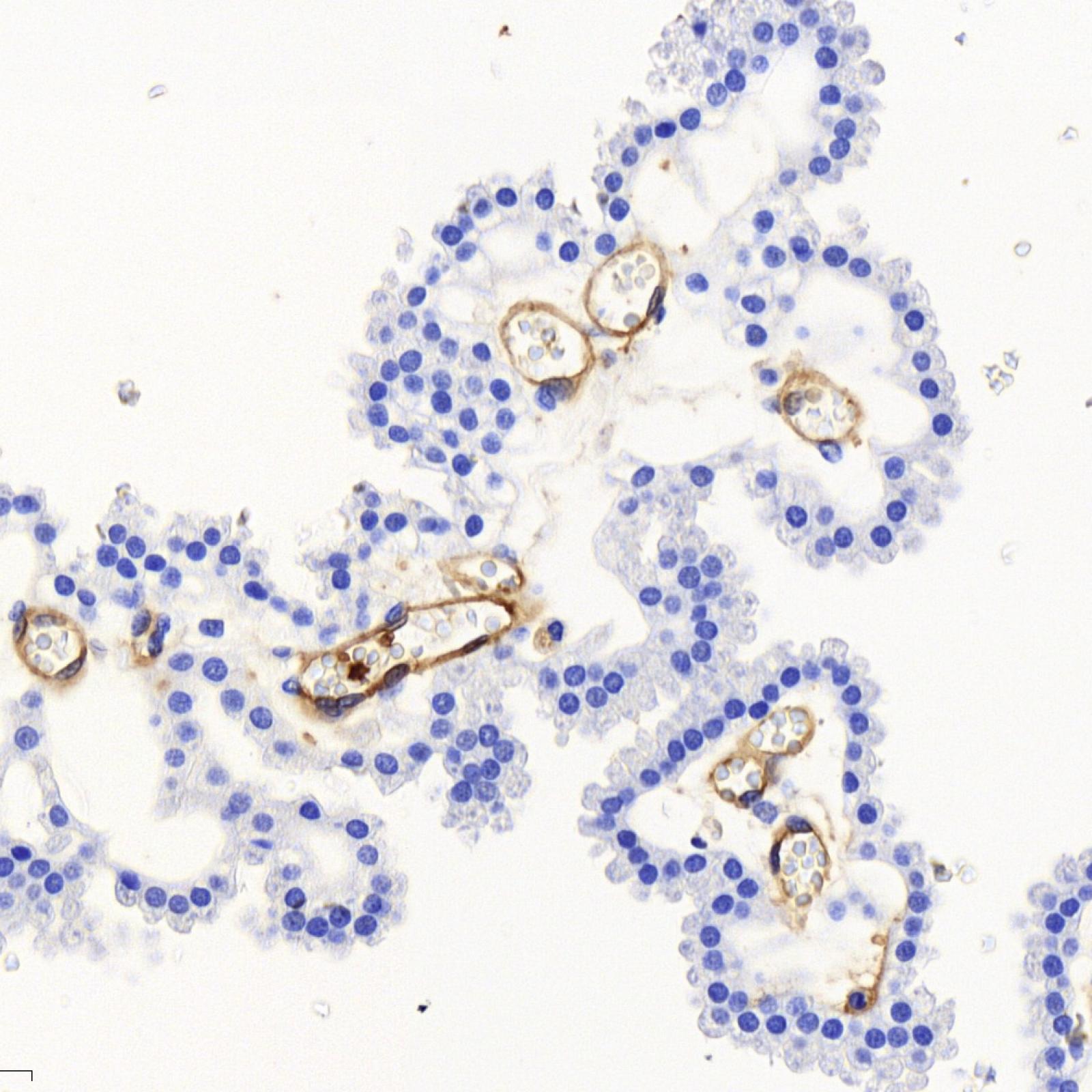
Notre autre modèle principal d'étude est un des deux Streptocoques majeurs, le Streptocoque de groupe B (SGB, Streptococcus agalactiae), impliqué dans des infections invasives graves se déclarant pendant la grossesse ou la période néonatale.
SGB appartient à la flore intestinale et vaginale de 10 à 30 % des adultes en bonne santé. Cependant, SGB est la principale cause d’infection néonatale. Notre but est de comprendre pourquoi une bactérie commensale chez l’adulte est un redoutable pathogène du nouveau-né. Nous identifions les mécanismes par lesquels SGB peut franchir des barrières physiologiques, digestives et hématoencéphaliques, et échapper au système immunitaire inné. Nous identifions les facteurs bactériens impliqués et les facteurs de l’hôte avec lesquels ils interagissent, ainsi que les prédispositions du nourrisson. Dans ce cadre, nous étudions la modification de facteurs cellulaires, la maturation de barrières physiologiques durant les premières semaines de vie et le microbiote du nouveau-né, en fonction de l’âge et de paramètres environnementaux tels que l’administration d’antibiotiques.
Enfin, Claire Poyart dirige le Centre National de Référence des Streptocoques (CNR-Strep) qui collecte les données cliniques envoyées par un réseau de laboratoires cliniques répartis sur l’ensemble du territoire national et caractérise au niveau moléculaire les souches responsables d’infections invasives et non-invasives.