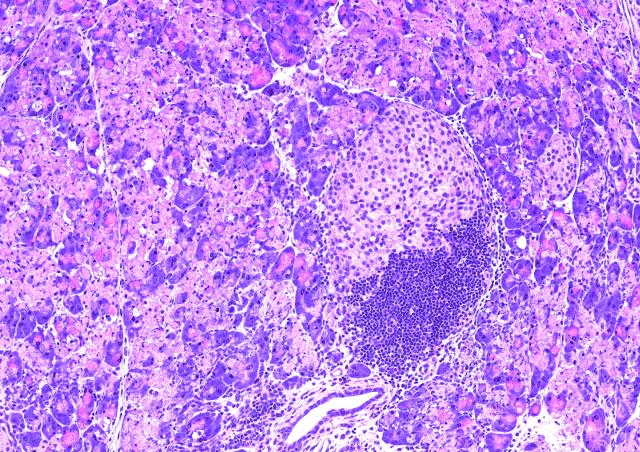
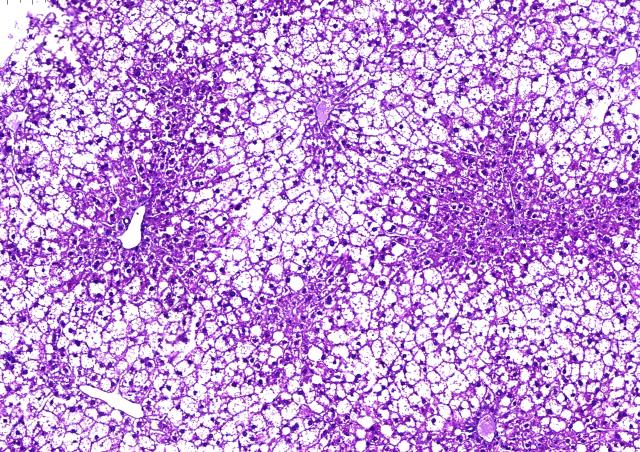
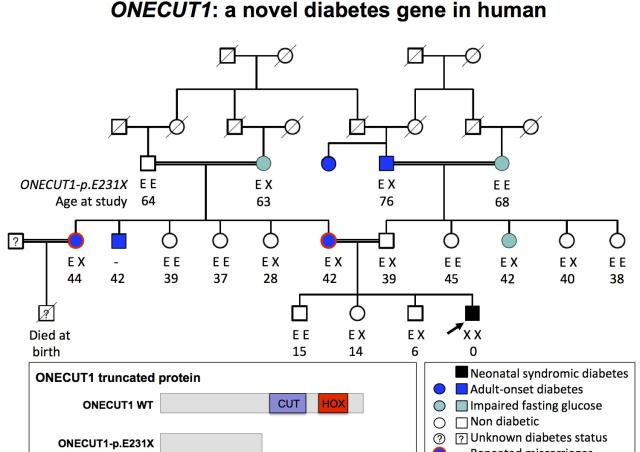
Le laboratoire se concentre sur les interactions entre les cellules immunitaires et l'îlot de Langerhans dans le diabète de type 1 : 1- le rôle des facteurs locaux des îlots, en particulier des signaux des lymphocytes T de costimulation, dans la tolérance immunitaire et son échec dans le diabète ; 2- l'identification d'épitopes majeurs de lymphocytes T spécifiques de la préproinsuline, un auto-antigène majeur dans le développement du diabète ; 3- le développement de modèles précliniques pour développer de nouvelles stratégies dans le diagnostic et le traitement du diabète de type 1 ; 4- le développement de l'immunothérapie dans le diabète de type 1 humain.
Membres du projet
Projet
Nous avons démontré le rôle central des cellules sécrétrices d'insuline dans l'échec de la tolérance immunitaire qui conduit au diabète de type 1, mettant en évidence le rôle clé de la préproinsuline en tant qu'auto-antigène majeur chez les souris NOD déficientes pour l'expression des gènes de l'insuline 1 ou de l'insuline 2 (3). Ainsi nous avons pu caractériser des épitopes d'insuline reconnus par les lymphocytes T et montrer chez la souris que l'expression de l'insuline dans le thymus contrôle le répertoire des lymphocytes T sélectionnés en périphérie (8). Chez des patients atteints de diabète de type 1, nous avons également caractérisé des épitopes d'insuline qui sont reconnus par les lymphocytes T CD4+ et CD8+ tout au long du processus du diabète (7 ; 6 ; 4). L'objectif actuel est de développer de nouveaux outils de diagnostic et de nouvelles stratégies de vaccination dans le traitement du diabète de type 1. Pour cela, nous avons développé un nouveau modèle préclinique de diabète de type 1 en générant une souris humanisée dépourvue de l'expression des gènes murins du complexe majeur d’histocompatibilité de classe I et de classe II ainsi que les 2 gènes de l’insuline, mais qui exprime les transgènes humains HLA-A*0201, HLA-DQ8, qui sont des facteurs de prédisposition génétique de la maladie, et l'insuline humaine (hINS) comme autoantigène (1). Enfin, le rôle de la costimulation des lymphocytes T est étudié chez des souris NOD dépourvues de l'expression d'ICOS ou de son ligand. Les souris ICOS-/- et ICOSL-/-NOD sont protégées du diabète, mais développent une maladie auto-immune qui affecte les cellules nerveuses et musculaires, ce qui indique que les interactions locales des lymphocytes T dans l'environnement des îlots sont un facteur clé de la tolérance immunitaire (5, 2).


Publications sélectionnées
Dernière préimpression : Differential action of TIGIT on islet and peripheral nerve autoimmunity in the NOD mouse de Chantal Bécourt, Sandrine Luce, Ute C. Rogner, Christian Boitard
bioRxiv 2023.11.24.568543; doi: https://doi.org/10.1101/2023.11.24.568543
1: Luce S, Guinoiseau S, Gadault A, Letourneur F, Nitschke P, Bras M, Vidaud M, Charneau P, Larger E, Colli ML, Eizirik DL, Lemonnier F, Boitard C. A Humanized Mouse Strain That Develops Spontaneously Immune-Mediated Diabetes. Front Immunol. 2021 Oct 14;12:748679. doi: 10.3389/fimmu.2021.748679. PMID: 34721418; PMCID: PMC8551915.
2: Van Rampelbergh J, Achenbach P, Leslie RD, Ali MA, Dayan C, Keymeulen B, Owen KR, Kindermans M, Parmentier F, Carlier V, Ahangarani RR, Gebruers E, Bovy N, Vanderelst L, Van Mechelen M, Vandepapelière P, Boitard C. First-in-human, double-blind, randomized phase 1b study of peptide immunotherapy IMCY-0098 in new-onset type 1 diabetes. BMC Med. 2023 May 24;21(1):190. doi: 10.1186/s12916-023-02900-z. PMID: 37226224; PMCID: PMC10210318.
3: Bourdenet G, Pileyre B, Drouot L, Martinet J, Bécourt C, Carrette M, Riou G, Bergua C, Jaworski T, Chan P, Jean L, Fréret M, Cosette P, Boitard C, Abad C,
Boyer O. Icos gene disruption in non-obese diabetic mice elicits myositis associated with anti-troponin T3 autoantibodies. Neuropathol Appl Neurobiol.
2023 Feb;49(1):e12889. doi: 10.1111/nan.12889. PMID: 36751013.
4: Houeiss P, Boitard C, Luce S. Preclinical Models to Evaluate the Human Response to Autoantigen and Antigen-Specific Immunotherapy in Human Type 1
Diabetes. Front Endocrinol (Lausanne). 2022 Apr 13;13:883000. doi: 10.3389/fendo.2022.883000. PMID: 35498419; PMCID: PMC9044628.
5: Luce S, Guinoiseau S, Gadault A, Letourneur F, Blondeau B, Nitschke P, Pasmant E, Vidaud M, Lemonnier F, Boitard C. Humanized Mouse Model to Study Type 1 Diabetes. Diabetes. 2018 Sep;67(9):1816-1829. doi: 10.2337/db18-0202. Epub 2018 Jul 2. PMID: 29967002.
6: Briet C, Bourdenet G, Rogner UC, Becourt C, Tardivel I, Drouot L, Arnoult C, do Rego JC, Prevot N, Massaad C, Boyer O, Boitard C. The Spontaneous Autoimmune Neuromyopathy in ICOSL<sup>-/-</sup> NOD Mice Is CD4<sup>+</sup> T-Cell and Interferon-γ Dependent. Front Immunol. 2017 Mar 31;8:287. doi: 10.3389/fimmu.2017.00287. PMID: 28424681; PMCID: PMC5371727.