Membres du projet
Projet
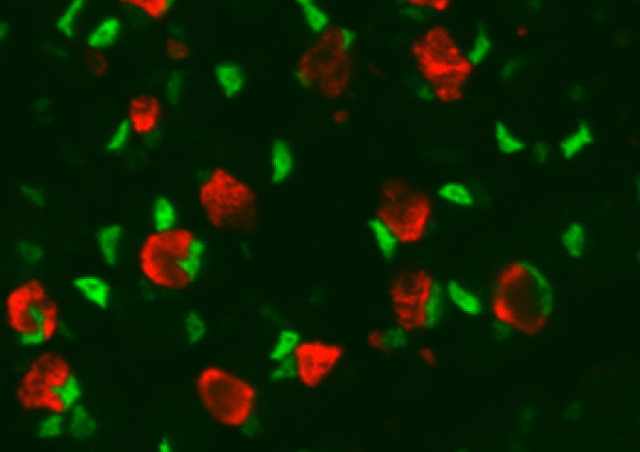
La croissance du coeur au cours de l’embryogenèse repose sur plusieurs populations cellulaires dont les cardiomyocytes (CM). Leur multiplication et leur arrangement en couches compactes pour former la paroi ventriculaire reposent sur plusieurs voies de signalisation dont certaines ont déjà été identifiées. L’absence du gène Lrrfip2 conduit à une mort embryonnaire précoce distinguée par l’absence d’épaississement des parois ventriculaires. Cette protéine est connue pour interagir avec différentes voies de signalisations en particulier au cours de l’inflammation et nous chercherons à préciser lesquelles sont altérées dans les CM mutants et sont responsables des défauts observés. Nous avons d’autre part mis en évidence que Lrrfip2 est exprimé dans les cellules souches musculaires (cellules satellites) adultes. Grâce à des modèles de souris mutantes conditionnelles pour Lrrfip2 nous caractériserons sa fonction au cours du processus de régénération du muscle squelettique adulte en condition aigue ou chronique (dans un modèle de souris mdx déficiente pour le gène Dystrophine).
We are studying the role of LRRFIP2 (Leucine rich repeat in Flightless interacting protein 2) during mouse embryonic cardiac development and during adult muscle regeneration:
- Lrrfip2-/- embryos die around embryonic day 13 due to severe cardiac malformations. Through transcriptomic studies we will identify the consequences of Lrrfip2 absence in the heart of embryos mutant for Lrrfip2 and identify the signaling pathways controlled by this protein and responsible for embryonic heart growth. Cell culture experiments with wt and mutant embryonic cardiomyocytes will allow to precise the mechanisms involved.
- Lrrfip2flox/flox:Pax7CREert2/+ and mdx:Lrrfip2flox/flox:Pax7CREert2/+ animals will be treated with Tamoxifen to induce the deletion of Lrrfip2 specifically in myogenic stem cells. The consequences of absence of Lrrfip2 in the capacity of mutant myogenic stem cells to repair skeletal muscle will be estimated after acute muscle injury or in a chronic model of regeneration (mdx). Cell culture of wt and mutant cells will allow to precise the mechanisms involved.