Membres du projet
Projet
Malgré le rôle central des myofibres dans la biologie musculaire, l’analyse des fonctions cellulaires et moléculaires des myonuclei (noyaux de myofibres) a été largement négligée. Pour des raisons techniques, on sait très peu de choses sur le rôle des différentes populations cellulaires et des sous-populations de myonuclei dans le contrôle de la plasticité musculaire. Grace à des méthodes innovantes (snRNAseq et RNAscope), nous projetons de comprendre comment l'hétérogénéité fonctionnelle des sous-domaines des myofibres est spécifiée et comment elle contribue à la plasticité musculaire dans des conditions atrophiques et hypertrophiques en fonction de la charge mécanique. Dans ce contexte nous identifions et étudions les cellules et populations nucléaires des myofibres responsables de la réponse aux stress mécaniques (Axe 1). Nous étudions également l’influence de la typologie de la fibre musculaire dans la réponse aux stimuli hypertrophiques et atrophiques (Axe 2).
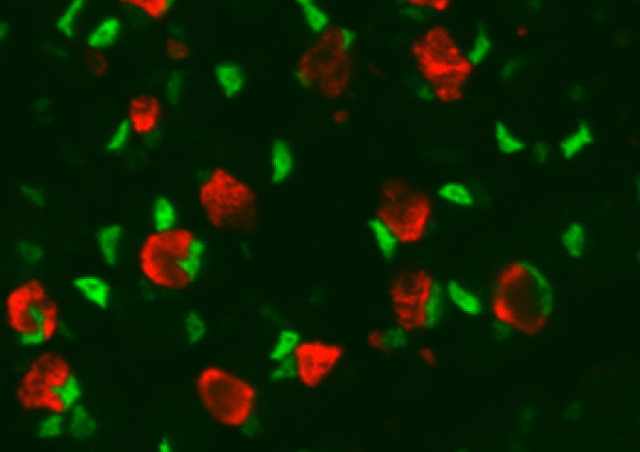
L’altération de la fonction musculaire squelettique est une caractéristique commune à plusieurs maladies et est associée à une augmentation de la mortalité des patients. La compréhension des mécanismes impliqués dans la régulation de la masse musculaire, de la typologie et du métabolisme présente donc un intérêt clinique. Le tissu musculaire squelettique est très hétérogène et est composé de différentes populations cellulaires telles que les myofibres, les cellules satellites, les ténocytes, les FAPs et les macrophages. De plus, les myofibres sont des syncytium contenant plus d'une centaine de noyaux par cellule répartis en différentes sous-populations, dont celles situées à proximité des jonctions neuromusculaires (NMJ) et des jonctions myotendineuses (MTJ).
Malgré le rôle central des myofibres dans la biologie musculaire, l’analyse des fonctions cellulaires et moléculaires des différents myonuclei (noyaux de myofibres) a été largement négligée. Pour des raisons techniques, on sait très peu de choses sur le rôle des différentes populations cellulaires et sous-populations de myonuclei dans le contrôle de la plasticité musculaire. La méthode de celle du snRNA-seq (optimisée dans notre équipe) permet de capturer la signature transcriptionnelle de tous les noyaux du tissu musculaire ce qui favorise l'identification du profil de transcription spécifique pour tous les myonuclei présents dans le muscle. Notre équipe a également standardisé la méthodologie hautement sensible RNAScope FISH (résolution de molécule d'ARN unique, pour les myofibres isolées). Cette technique est complémentaire avec snRNA-seq et permet l'analyse de la localisation spatiale des biomarqueurs de plasticité. En utilisant ces méthodes innovantes et sur la base de résultats préliminaires solides, nous projetons de comprendre comment l'hétérogénéité fonctionnelle des sous-domaines des myofibres est spécifiée et contribue à la plasticité musculaire dans des conditions atrophiques et hypertrophiques en fonction de la charge mécanique.

Objectif 1 :
- Comprendre le rôle de l’environnement et de l’hététogénéité (différentes population de myonuclei) de la fibre musculaire dans son adaptation aux stress mécaniques
- identifier les mécanismes moléculaires impliqués dans les dialogues entres les cellules du tissu musculaire et/ou des sous domaines de la fibre au cours de l’hypertrophie et de l’atrophie.
Objectif 2 :
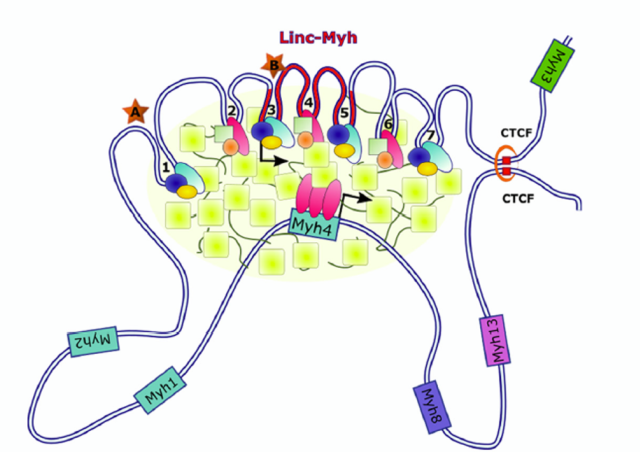
Etudier l'interaction entre la typologie des myofibres et le contrôle de la masse musculaire. Le tissu musculaire peut contenir quatre types de myofibres différents classés selon l’expression des isoformes de myosine et leur métabolisme (Myh7 oxydative lente de type I, Myh2 intermédiaire / oxydative lente de type IIa, Myh1 intermédiaire / glycolytique rapide IIx, Myh4 glycolytique rapide type IIb). De façon intéressante, la typologie des myofibres varie en réponse à des stimuli hypertrophiques et atrophiques. Notre objectif est de comprendre les mécanismes et l'importance du changement du typage de myosine dans la plasticité musculaire. Nous projetons également de déterminer si l'expression des isoformes de myosine prédétermine l'adaptation des myofibres à l'hypertrophie et à l'atrophie.