Membres du projet
Projet
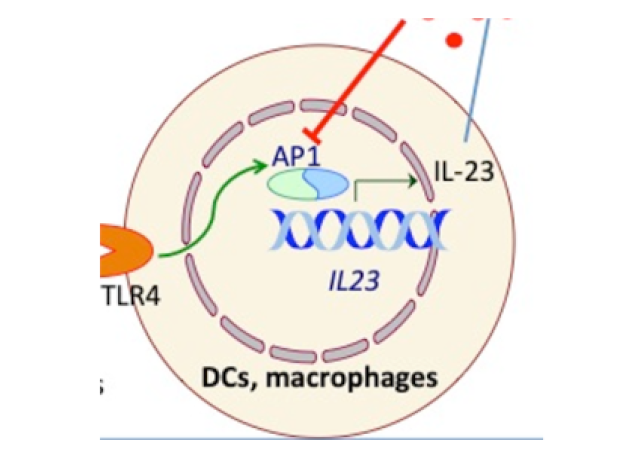
Après une adhésion précoce aux cellules endothéliales médiée par la molécule CD147, N. meningitidis, la bactérie impliquée dans la méningite cérébréospinale chez l’homme, active spécifiquement dans les cellules hôte le récepteur b2-adrénergique humain (β2AR), un membre de la famille des récepteurs couplés aux protéines G (RCPG). Le β2AR est activé allostériquement par PilE et PilV, deux composants des pili de type IV du méningocoque (Tfp), qui interagissent avec des résidus d’acide sialique terminant les deux chaines glycaniques de la région N-terminale du récepteur. Nous avons montré que ce sont des forces de traction exercés par le pathogène et par le flux sanguin, appliquées sur les chaines glucidiques du récepteur, qui déclenchent son activation.
Le projet vise à caractériser les forces physiques qui activent ce RCPG at à déterminer le rôle physiologique potentiel de cemode d’activation, par exemple dans le contexte d’interactions inter-cellulaires.
Comme le récepteur d’adhésion au méningocoque (le CD147) et le β2AR sont pré-associés dans les cellules endothéliales, nous étudions aussi la fonction physiologique de cet hétérodimère.

Projet MECAD-R
Voies de signalisation en aval du β2AR activé mécaniquement et leur rôle physiologique
La voies de signalisations physiologiques associées à l'activation mécanique du β2AR restent à établir. Une approche globale sera utilisée consistant en l'identification de l'interactome du récepteur β2AR induit par l'activation mécanique du récepteur. Cette activation mécanique peut être induite par une infection avec le méningocoque ou via des billes enrobées de lectines, qui se lient à l'acide sialique terminal des chaines glucidiques du récepteur, soumises à des forces centrifuges ou à un écoulement liquide. Plus précisément, nous utiliserons une expérience de marquage de proximité catalysée par une enzyme, basée sur la technologie TurboID, couplée à la spectrométrie de masse (MS) à haute résolution. Cette procédure permet d'étudier l'interactome d'une protéine donnée en catalysant la biotinylation de partenaires proches/en interaction. TurboID est un mutant de la biotine ligase d'Escherichia coli possédant une efficacité catalytique élevée, permettant un marquage de proximité rapide (10 min) et non toxique de la biotine dans des cellules vivantes de levure, de mouche et de mammifère.
Les proies biotinylées sont ensuite purifiées à l'aide de billes recouvertes de streptavidine et identifiées par MS. Dans notre étude, nous utiliserons TurboID pour marquer le β2AR et donc identifier les partenaires récepteurs proches marqués sélectivement lors de son activation mécanique. Pour cet objectif, les proies isolées après activation par l'isoprotérénol (catécholamine) seront comparées à des proies isolées lors de l'activation du récepteur par billes ou par le méningocoque. Les proies significativement enrichies dans ces dernières conditions seront considérées comme potentiellement sélectives de la mécano-transduction. Pour étudier de manière sélective les partenaires protéiques du complexe CD147 et β2AR pré-établi, chaque protéine sera fusionnée à l'une des 2 moitiés de l'enzyme, générées génétiquement, qui reconstitueront une enzyme fonctionnelle en raison de leur proximité dans le complexe.
Les propriétés mécano-transductrices du β2AR suggérées par nos données suggèrent une fonction auparavant non appréciée de ce récepteur dans le système vasculaire. Par exemple, les cellules sanguines exprimant des protéines telles que la sialoadhésine SIglec-1 (qui reconnaissait spécifiquement les sucres terminaux trouvés dans les chaînes glucidiques du β2AR) pourraient se lier et activer le β2AR des cellules endothéliales dans le contexte de l'interactions de cellule à cellule et/ou de la diapédèse. Nous étudions l'hypothèse ci-dessus en utilisant la lignée cellulaire de microvascularisation cérébrale humaine (HDEMEC/D3) que nous avons utilisée pour caractériser l'interaction du méningocoque avec la cellule endothéliale β2AR2.
Ce projet est mené en collaboration avec l'équipe de Mathieu Coureuil à l'Institut Necker Enfants Malades.