Réponse des cellules endothéliales à l’infection par Neisseria meningitidis
Responsable(s) de projet
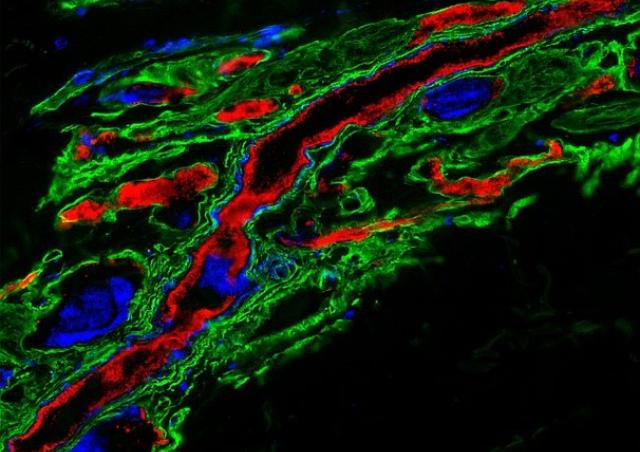
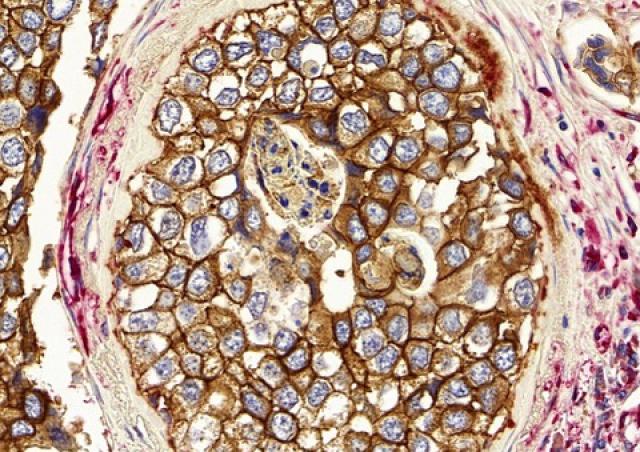
Notre équipe étudie les interactions complexes entre Neisseria meningitidis (méningocoque) et les vaisseaux périphériques et cérébraux humains, deux interactions au cœur de la pathogénèse du méningocoque (purpura nécrotique et méningite) (1, 2). Nous cherchons à comprendre comment N. meningitidis manipule la réponse des cellules endothéliales pour établir une interaction intime et induire des dysfonctionnements, ruptures et/ou brèches dans les barrières endothéliales (3, 4). Nous avons identifié les facteurs clés de l'hôte et de la bactérie impliqués dans ces interactions (5-9) (brevet WO 2014/016152 A1). En outre, nous avons identifié des composés qui ciblent les pili de type IV, réduisent la colonisation vasculaire par les méningocoques et préviennent les dysfonctionnements vasculaires, la coagulation intravasculaire et l'inflammation exarcerbée consécutifs à cette colonisation (10) (Brevets WO/2017/121755 ; WO/2018/083314). A l’aide d'un modèle in vivo d'infection méningococcique, nous visons à caracteriser les événements moléculaires et cellulaires conduisant à la dysfonction vasculaire, à la thrombose, à la défaillance d’organes et à l'échappement de cette bactérie au système immunitaire.
Au niveau du système nerveux central, les cellules endothéliales microvasculaires du cerveau forment la barrière hémato-encéphalique (BHE), une barrière hautement spécialisée au niveau structural et biochimique, qui préserve l'homéostasie du cerveau. Notre équipe a mis au point une lignée unique de cellules endothéliales cérébrales humaines (hCMEC/D3) qui reproduit la BHE humaine normale, comme en témoignent la faible perméabilité, la sécrétion et le transport polarisés, l'organisation architecturale et le profil d’expression des protéines dans ces cellules (11, 12) [brevet WO/2006/056879, maintenant distribué dans plus de 300 laboratoires dans le monde et sous licence avec plusieurs sociétés pharmaceutiques]. A l’aide de ce modèle, nous cherchons à élucider les stratégies moléculaires mises en place par Neisseria meningitidis pour coloniser la vascularisation du cerveau humain et accéder au cerveau avec une perte minimale de l'intégrité de la BHE (13). Nos objectifs sont d'identifier les mécanismes potentiels de protection du cerveau contre les dommages vasculaires locaux dus aux infections bactériennes, avec l'objectif ultime de mettre en œuvre des mécanismes de protection endothéliale pour limiter les processus hémostatiques et inflammatoires néfastes associés à ces infections.
1. (Coureuil et al., 2014) 2. (Coureuil et al., 2017) 3. (Lemichez et al., 2010) 4. (Coureuil et al., 2013) 5. (Coureuil et al., 2010) 6. (Bernard et al., 2014) 7. (Maissa et al., 2017) 8. (Le Guennec et al., 2020) 9. (Dos Santos Souza et al., 2020) 10. (Denis et al., 2019) 11. (Weksler et al., 2005). 12. (Weksler et al., 2013) 13. (Le Guennec et al., 2020).