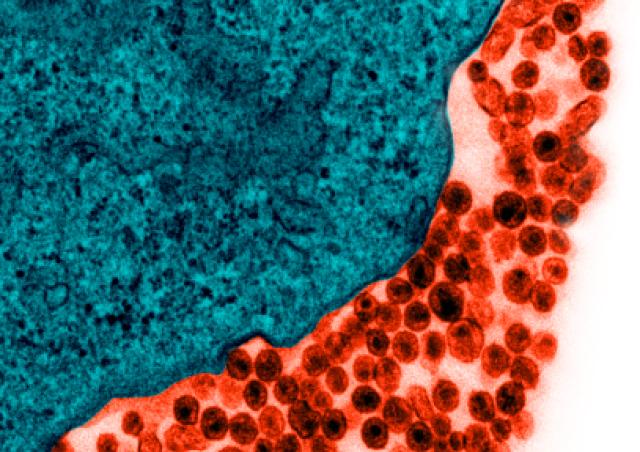
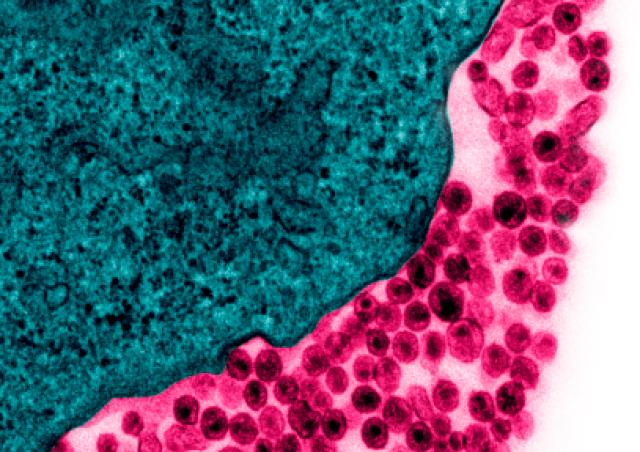
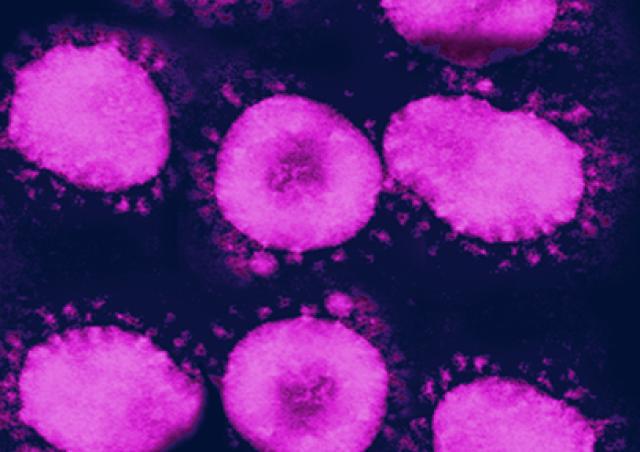
Malgré l’efficacité des thérapies antirétrovirales actuelles, l'infection par le VIH-1 ne peut pas être éradiquée car le virus est capable de persister dans un état latent pendant de longues durées dans des réservoirs cellulaires, tels que les cellules mémoires CD4+T. La latence décrit la persistance des cellules hébergeant des virus compétents pour la réplication mais transcriptionnellement silencieux.
Nous étudions les mécanismes qui contrôlent le devenir de l'expression des gènes du VIH, une fois le virus intégré dans le génome de la cellule hôte. Nous explorons la relation qui existe entre l'intégration du VIH et sa transcription. Nous étudions
comment l'environnement de la chromatine et la machinerie transcriptionnelle participent à l'inhibition de la transcription du VIH dans les cellules latentes.
Notre objectif est d'identifier les facteurs clés contrôlant l'inhibition et la réactivation transcriptionnelle du VIH-1. Ces facteurs sont les cibles potentielles des futures thérapies visant neutraliser ces réservoirs, que ce soit par la réactivation du VIH latent afin de les purger (l'approche “shock and kill“) ou au contraire par l’induction d’une phase de latence profonde pour bloquer le rebond viral (l'approche “block and lock“).
Membres du projet

1 - Mécanismes d’inhibition de la transcription du VIH-1
L’inhibition de la transcription virale dans les cellules infectées latentes est le résultat de processus multifactoriels tels que l'influence de la structure de la chromatine au niveau des sites d'intégration, la disponibilité des facteurs de transcription ou encore le rôle des facteurs épigénétiques et des complexes de remodelage de la chromatine qui régulent l'architecture nucléosomique du provirus intégré. Bien que les mécanismes contrôlant la latence du VIH soient très hétérogènes, ils conduisent tous à maintenir la transcription virale à un niveau faible, empêchant l'accumulation du transactivateur viral Tat. En l'absence de Tat, la transcription du VIH-1 est réprimée par la pause proximale de l’ARN polymerse II (ARNPII) au niveau du promoteur et par la terminaison prématurée de la transcription (PTT), conduisant ainsi à l'accumulation de courts transcrits abortifs qui sont notamment détectés dans les cellules d'individus infectés. Nous explorons comment les complexes associés à l'ARN polymérase II sont impliqués dans l'arrêt prématuré de la transcription du VIH dans les cellules latentes (Figure 1).
2 - Contrôle épitranscriptomique de l'expression du VIH-1
La N6-méthyladénosine (m6A) est la modification la plus abondante retrouvée sur les ARNm. Elle est déposée de manière co-transcriptionnelle par un complexe Methyltransferase METTL3-METTL14. La marque m6A favorise directement le recrutement de “readers“ m6A impliqués dans la régulation de la biogenèse des ARN. Les protéines “readers“ YTH comprennent les 3 paralogues cytoplasmiques, YTHDF1, YTHDF2, YTHDF3, ainsi que la protéine nucléaire YTHDC1. Grâce à ces “readers“, la marque m6A régule les étapes du métabolisme des ARNm. Récemment, la modification m6A a été identifiée sur les transcrits du VIH-1. Nous étudions comment la modification m6A régule le sort des ARN du VIH et impacte la réplication virale.