Membres du groupe Matkovic
Projet
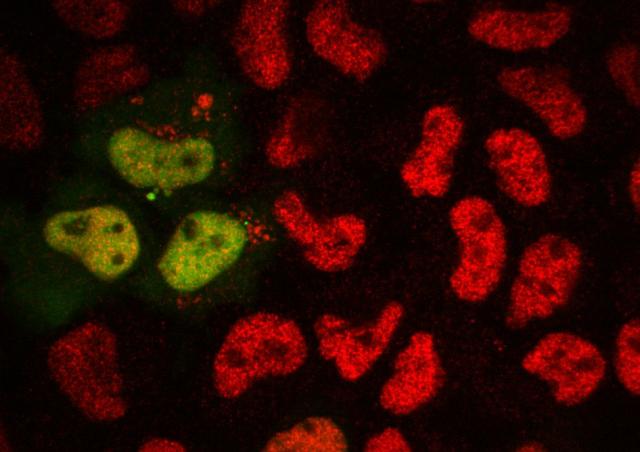
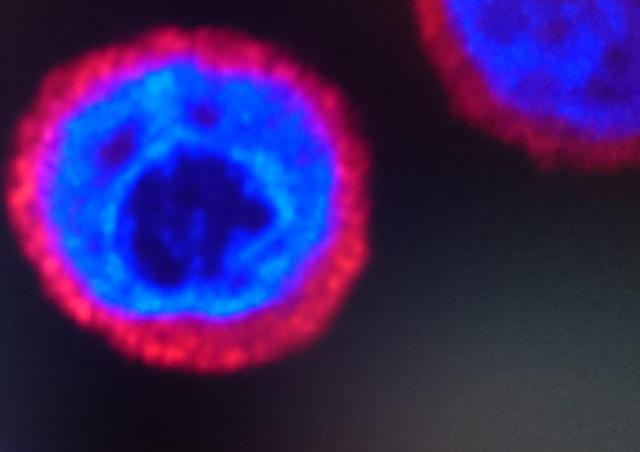
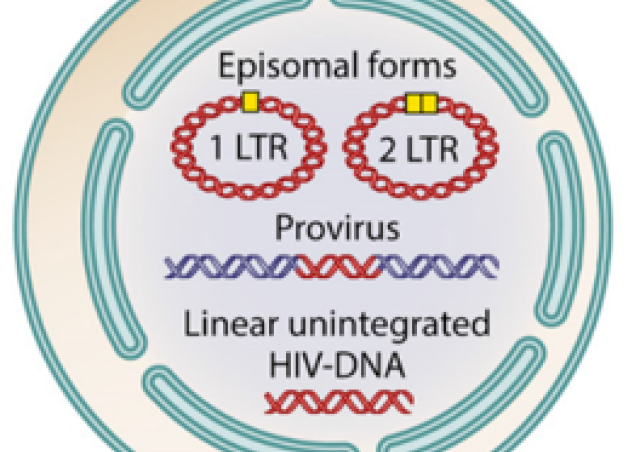
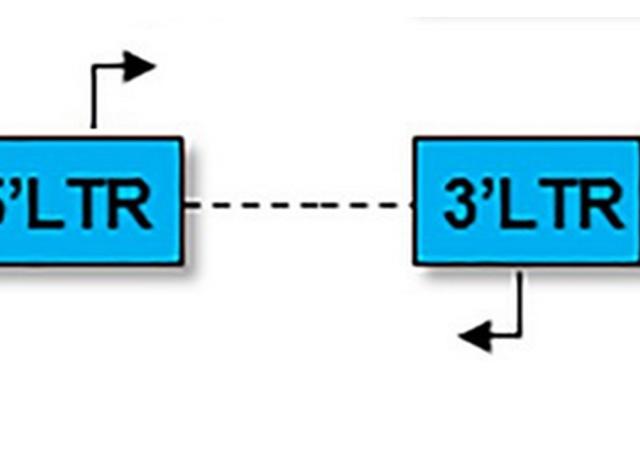
Le groupe de Roy MATKOVIC a découvert un nouveau mécanisme d'extinction des gènes dans les cellules humaines qui relie l'extinction épigénétique et la dégradation de l'ARN : HUSH interagit avec CNOT1, l'ARN exosome nucléaire pour induire la dégradation de la transcription de l’ARN transcrit à partir du LTR du VIH-1, tout en induisant l'hétérochromatinisation du provirus par la propagation de H3K9me3 (Matkovic et al, Nature Communications 2022). Ce nouveau type de mécanisme de répression de l'expression de gènes chez les mammifères démontre un lien étroit entre le métabolisme de l'ARN et la répression transcriptionnelle des gènes.
Le groupe de Roy MATKOVIC cherche à comprendre, avec des approches biochimiques, génétique, épigénétique, et moléculaires, comment l'ARN génomique du VIH-1 et les ARNs non codant organisent l'assemblage de complexes macromoléculaires de la cellule hôte pour empêcher l’expression du VIH-1 et entrainent sa mise en latence.
Collaborations
Internes:
Florence MARGOTTIN-GOGUET
Véronique AVETTAND-FENOEL
Locales:
-Stéphane EMILIANI - Institut Cochin
Nationales:
-Gael CRISTOFARI - IRCAN Nice
Internationales:
-Maike HANSEN - Radbud University - NED
Publications
TASOR epigenetic repressor cooperates with a CNOT1 RNA degradation pathway to repress HIV.
Matkovic R✉, Morel M, Lanciano S, Larrous P, Martin B, Bejjani F, Vauthier V, Hansen MMK, Emiliani S, Cristofari G, Gallois-Montbrun S, Margottin-Goguet F✉.
Nat Commun. 2022 Jan 10;13(1):66. doi: 10.1038/s41467-021-27650-5. (✉: co-corresponding)
HUSH-mediated HIV silencing is independent of TASOR phosphorylation on threonine 819.
Vauthier V, Lasserre A, Morel M, Versapuech M, Berlioz-Torrent C, Zamborlini A, Margottin-Goguet F✉, Matkovic R✉. Retrovirology. 2022 Oct 29;19(1):23. doi: 10.1186/s12977-022-00610-7 (✉ : co-corresponding)
Binding to DCAF1 distinguishes TASOR and SAMHD1 degradation by HIV-2 Vpx.
Martin MM*, Matkovic R*, Larrous P, Morel M, Lasserre A, Vauthier V, Margottin-Goguet F. PLoS Pathogens 2021 Oct 26;17(10):e1009609. doi: 10.1371/journal.ppat.1009609. (*: co-first)
HIV-2/SIV viral protein X counteracts HUSH repressor complex.
Chougui G, Munir-Matloob S, Matkovic R, Martin MM, Morel M, Lahouassa H, Leduc M, Ramirez BC, Etienne L, Margottin-Goguet F. Nat Microbiol. 2018 Aug;3(8):891-897. doi: 10.1038/s41564-018-0179-6.