Dans les années 1990 le Pr Jean-Philippe Wolf travaillait dans le laboratoire d’Assistance Médicale à la Procréation de l’Hôpital du Kremlin Bicêtre, puis de l’Hôpital Cochin à Paris et collaborait avec G. Palermo du service du Pr Van Steirteghem, à Bruxelles. Il s’agissait de mettre au point les techniques de micro-injection de spermatozoïdes dans les ovules, pour en améliorer les taux de fécondation chez les couples dont le conjoint avait un sperme particulièrement déficient.
La première technique envisagée consistait à microinjecter les spermatozoïdes sous la Zone Pellucide qui entoure l’ovocyte (Figure 1). Cette technique s’appelait SUZI pour « Sub Zonal Insémination ». G. Palermo, lors d’une telle tentative de SUZI, a fait entrer directement le spermatozoïde à l’intérieur de l’ovule et a ainsi créé l’ICSI, que tout le monde connaît, et qui a permis la naissance de nombreux enfants.
Le groupe recherche de Jean-Philippe Wolf s’est alors intéressé à l’identification des protéines de l’interaction entre les gamètes, permettant la reconnaissance, l’adhésion et la fusion des membranes gamétiques. A cette période le groupe de P. Primakoff à UCLA venait de publier dans Cell un article dans lequel il suggérait que le récepteur du spermatozoïde sur la membrane de l’ovocyte de souris, était l’intégrine α6β1.
L’Equipe a voulu, dans un premier temps, vérifier si cela était la même chose dans l’espèce humaine. Mais au lieu d’utiliser classiquement des anticorps contre la sous-unité intégrine α6 ou β1, Morgane Bomsel de l’Institut Cochin, également impliquée dans ce projet, a eu l’idée de synthétiser un peptide reproduisant le ligand présomptif du spermatozoïde. Si le récepteur était l’intégrine α6β1, le ligand devait être le domaine disintégrine de la protéine ADAM2 autrement appelée la Fertiline β. Un peptide reproduisant son site de fixation, à quelques modifications près, le peptide FEE, a donc été synthétisé.
Le peptide FEE augmente le taux de fécondation, in vitro
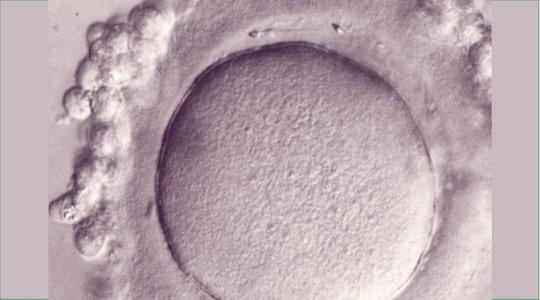
Le seul modèle sur lequel pouvait être testé le peptide dans l’espèce humaine était le modèle de l’ovocyte immature bloqué au stade de Vésicule Germinale (VG), et donné pour la recherche. Effectivement ces ovocytes ne sont pas utilisables pour le projet d’enfant du couple, leur méïose est bloquée au 1er stade.
Il fallait dépellucider les VG (fig. 1a) pour éviter de créer un embryon ce qui était interdit dans le cadre de la recherche. Une vingtaine de spermatozoïdes peuvent alors fusionner avec l’ovocyte dépellucidé, puisqu’il n’existe plus le blocage de la polyspermie normalement localisé au niveau de la Zone Pellucide.
De tels ovocytes ont donc été inséminés avec ou sans le peptide FEE dans le but de réaliser une inhibition dose-dépendante de la fécondation avec la molécule. Les spermatozoïdes fusionnés ont été marqués par fluorescence (Hoechst). Les chercheurs ont eu alors l’énorme surprise de constater que contrairement à ce qui était attendu, la molécule n’inhibait pas le passage des spermatozoïdes à l’intérieur de l’ovule mais au contraire en augmentait leur nombre (Figure 2b et c) (Ziyyat et al., Cyclic FEE peptide increases human gamete fusion and potentiates its RGD-induced inhibition. Hum Reprod. 2005).

Pour surprenante, la découverte n’en était pas moins très intéressante puisqu’elle permettait d’améliorer les taux de fécondation lors de Fécondations In Vitro (FIV) ce qui représentait un saut technologique important et répondait à un défi sociétal. L’Assistance Publique et l’Université ont donc pris un Brevet sur la molécule et une demande d’autorisation d’Essai Clinique a été déposée auprès de l’Agence de la Biomédecine.
Le peptide FEE issu de la Fertiline murine augmente le taux de fécondation in vivo chez la souris
Pour avoir l’autorisation d’Essai Clinique, des études in vivo ont été réalisées chez la souris. Il a ainsi été montré, sur des complexes cumulo-ovocytaires intacts (ovocytes matures entourés de cellules folliculeuses, figure 1), que le peptide homologue issu de la Fertiline murine, avait les mêmes propriétés que le peptide FEE humain, et surtout qu’il permettait d’obtenir des progénitures saines se reproduisant normalement sur 3 générations (Barraud-Lange et al., Cyclic QDE peptide increases fertilization rates and provides healthy pups in mouse. Fertil Steril. 2009).
Le peptide FEE améliore la maturation des ovules humains et la ségrégation des chromosomes au cours de la méiose I
Les propriétés du peptide sur la maturation des ovocytes humains ont ensuite été étudiées plus en détail. Le modèle utilisé était celui de la maturation in vitro des ovocytes bloqués au stade de VG, mais avec Zone Pellucide intacte cette fois. Plus de 1600 ovocytes ont été inclus dans l’étude, ce qui a permis de montrer que le peptide FEE améliorait de 30% leur taux de maturation par rapport au groupe témoin. Dans le cadre d’une collaboration avec le Service du Pr Serge Romana (Hôpital Necker), une technique d’analyse chromosomique par puces d’ADN (CGH array) a été mise au point sur cellule unique, pour établir la formule chromosomique des ovocytes ainsi maturés.
Pour donner un enfant après fécondation, un ovocyte doit avoir terminé sa méiose et surtout être euploïde (c’est-à-dire avoir le nombre normal de chromosomes), cette propriété diminuant singulièrement avec l’âge des femmes, ce qui est une cause de la baisse de leur fertilité. Or de façon surprenante, le peptide FEE a aussi amélioré la ségrégation des chromosomes au cours de la méiose I et le taux d’euploïdie des ovocytes maturés au stade de M II (Sallem et al., A fertilin-derived peptide improves in vitro maturation and ploidy of human oocytes. F S Sci. 2022).
Le peptide FEE améliore le développement pré-implantatoire in vitro des embryons humains et l’éclosion des blastocystes
Le groupe de JP Wolf a alors obtenu une autorisation de « recherche sur l’embryon humain » de l’Agence de la Biomédecine. Il s’agit d’embryons obtenus pour des couples qui, n’ayant plus de projet parental, en font don à la recherche.
Après vérification que le peptide marquait effectivement les blastomères des embryons J2 à leur interface, une étude dose-réponse de la blastoformation sur 4 jours a été réalisée. Ces travaux ont ainsi mis en évidence une stimulation dose dépendante de la blastoformation de ces embryons par le peptide FEE, et de façon intéressante une augmentation du nombre de cellules du trophectoderme (futur placenta) sans modification du bouton embryonnaire (qui lui, donnera le bébé). Or le nombre de cellules du trophectoderme est la variable la plus corrélée au pourcentage de naissances vivantes. De plus, le taux d’éclosion spontanée de ces embryons était multiplié par 3 démontrant ainsi leur capacité évolutive (Denizot et al., Cyclic fertilin-derived peptide stimulates in vitro human embryo development. F S Sci. 2022 Feb;3(1):49-63).
Essais cliniques de FIV avec le peptide FEE
Un premier essai clinique a débuté en 2015, mais n’a pu durer que 3 mois pour des raisons administratives (anomalie lors de la révision de la loi de Bioéthique …). Au cours de ce premier essai, 66 couples ont été inclus pour des FIV, leurs ovocytes étant répartis de façon randomisée en deux groupes, et inséminés avec le sperme du conjoint en présence ou non de la molécule FEE. Le pourcentage des naissances a augmenté de 7 % dans le groupe traité par rapport au groupe témoin, et ce pourcentage monte à 13% lors du premier transfert réalisé avec l’embryon de la cohorte présentant le meilleur pronostic.
Un essai clinique de phase 3 dont l’AP-HP est Promoteur est actuellement en cours. Il inclura 360 couples répartis en deux groupes, dans 8 établissements de soin pratiquant l’Assistance Médicale à la Procréation. Les bébés seront suivis durant un an. Résultats en 2025 … Avec à la clé une demande d’AMM.