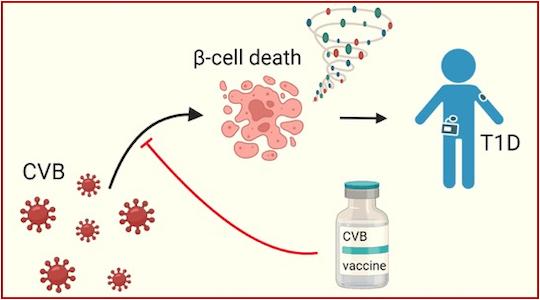
Malgré le manque de preuves d'une relation causale, les infections à CVB sont reconnues comme des déclencheurs environnementaux plausibles pour le DT1, en raison de leur corrélation temporelle avec l’apparition des auto-anticorps dirigés contre les cellules bêta (premiers signes mesurables révélateurs de l’auto-immunité), et de la détection du virus dans le pancréas de patients diabétiques. De plus, le CVB peut infecter directement et efficacement les cellules bêta, menant à leur mort. Ces observations ont conduit au développement d'un vaccin PRV-101 contre le CVB, qui a fait l’objet d’un essai clinique pilote dont les résultats sont prometteurs en termes de sécurité et d’induction d’anticorps antiviraux protecteurs. Avant de se lancer dans des essais sur une plus large échelle, il est apparu important de mieux comprendre l'immunité induite par le CVB. Alors que les réponses anticorps ont été largement étudiées, celles des lymphocytes T CD8+ (lyT8), acteurs centraux des réponses antivirales, ainsi que des réponses auto-immunes contre les cellules bêta, étaient largement inconnues.
Les chercheurs ont d’abord infecté des cellules bêta in vitro avec le CVB afin d’étudier les antigènes viraux exposés à la surface pour la reconnaissance immunitaire des cellules infectées. Ces expériences ont montré que le CVB se « cache » très efficacement à l’intérieur des cellules bêta, en exposant peu d’antigènes. De plus, le CVB passe d’une cellule bêta à l’autre en utilisant des protrusions cellulaires, en évitant ainsi davantage la reconnaissance immunitaire.
Dans une deuxième étape, les antigènes viraux ont été utilisés comme des « appâts » moléculaires pour détecter les lyT8 circulants pouvant les reconnaitre chez des individus qui avaient été infectés dans le passé. Ces expériences ont révélé une deuxième surprise : la réponse des lyT8 vis-à-vis du CVB est très faible, et ne conduit pas à la formation d’une « mémoire » immunitaire efficace (capable de protéger l’individu en cas de réinfection).
La troisième étape a consisté à isoler ces lyT8 pour les mettre en contact in vitro avec des cellules bêta infectées. Ces expériences ont montré que les cellules bêta étaient détruites majoritairement par le CVB, mais épargnées par les lyT8 antiviraux (censés pourtant tuer les cellules infectées afin de limiter la propagation de l’infection).
Légende de la figure : Lorsque l'infection survient, le CVB se «cache» dans les cellules bêta pancréatiques et, favorisé par de faibles réponses immunitaires anti-CVB, peut directement entraîner la destruction des cellules bêta en libérant des auto-antigènes et en déclenchant la réponse auto-immune du DT1. La vaccination anti-CVB serait utile afin de renforcer les faibles réponses immunitaires et de restreindre la propagation du virus, ce qui pourrait constituer une stratégie de prévention primaire du DT1.
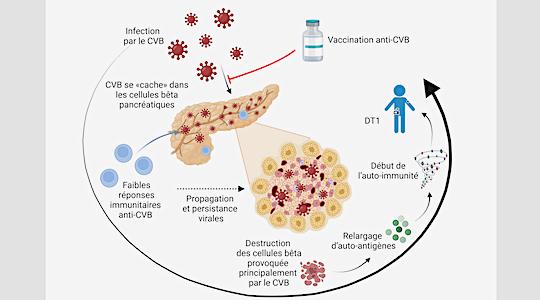
Ces résultats sont importants car, avant cette étude, deux scénarios pouvaient expliquer comment le CVB déclenche le DT1. Premièrement, de faibles réponses immunitaires anti-CVB favoriseraient la propagation et la persistance virales, entraînant ainsi une destruction des cellules bêta provoquée principalement par le virus lui-même. Deuxièmement, de fortes réponses immunitaires antivirales pourraient conduire à une destruction des cellules bêta infectées par les lyT8 antiviraux recrutés suite à l’infection. Si, dans les deux cas, le résultat final est la libération d'auto-antigènes de la cellule bêta dans un contexte d’inflammation et le déclenchement de la réponse auto-immune du DT1, les implications pour les stratégies de vaccination sont différentes. En effet, la vaccination anti-CVB serait utile pour renforcer des réponses immunitaires faibles et ainsi limiter la propagation virale, mais potentiellement dangereuse si elle devait conduire à une réponse antivirale augmentée contre les cellules bêta.
Ces résultats démontrent un effet destructeur premier et direct du CVB sur les cellules bêta, favorisé par de faibles réponses immunitaires antivirales. Il est donc pertinent d’essayer de renforcer ces réponses par une vaccination, ce qui pourrait fournir une stratégie de prévention primaire du DT1, en intervenant sur les facteurs déclencheurs avant même le début de l’auto-immunité. De plus, ces résultats expliquent comment une infection très répandue comme celle au CVB mène à un DT1 seulement chez quelques individus : ce n’est pas l’infection elle-même qui est en cause, mais la réaction plus ou moins efficace du système immunitaire contre cette infection qui, si défaillante, favorise la propagation du CVB aux cellules bêta et leur destruction.
Ces études continuent maintenant dans le cadre d’un réseau européen ENT1DEP (www.ent1dep.eu) afin de fournir de nouveaux moyens de détecter précocement un risque de développement du DT1 suite à une infection par le CVB et de poursuivre le développement clinique du vaccin. Une origine virale étant suspectée également pour d’autres maladies auto-immunes, par exemple la sclérose en plaques, ces recherches pourraient élargir leur pertinence au domaine de l'auto-immunité au sens large.
En savoir plus
Federica Vecchio et al. Coxsackievirus infection induces direct pancreatic β cell killing but poor antiviral CD8+ T cell responses. Sci. Adv.10,eadl1122(2024). DOI:10.1126/sciadv.adl1122