Membres du projet
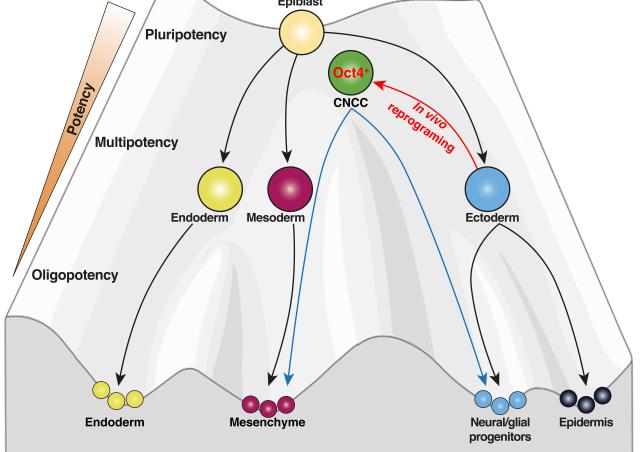
En général la diversité cellulaire augmente au cours du développement des vertébrés. Cependant, les cellules des crêtes neurales crâniales passent par une phase de convergence transcriptionnelle lors de leur différenciation.
J'ai montré qu'avant leur migration, les cellules des crêtes neurales crâniales possèdent une information de position moléculaire unique qui reflète leur site d'origine dans le neuroépithélium crânien. Mais cette hétérogénéité moléculaire est rapidement effacée. En effet, lors de la migration, les cellules de crêtes neurales crâniales n’expriment plus les gènes de position antérieur-postérieur mais présentent une signature moléculaire homogène. Cela indique que ces cellules acquièrent un certain niveau de plasticité, leur permettant de s'adapter aux futurs signaux environnementaux qu’elles rencontrent au cours de leur migration.
Les mécanismes moléculaires qui régissent la manière dont les cellules de crêtes neurales crâniales diminuent leur hétérogénéité cellulaire et contrôlent leur plasticité par des changements transcriptionnels et épigénétiques restent inconnus.

Pour comprendre comment les cellules des crêtes neurales crâniales maintiennent un haut niveau de plasticité tout au long du développement, nous cherchons à déchiffrer les programmes transcriptionnels et les réarrangements chromatiniens qui contrôlent l'établissement de l'hétérogénéité moléculaire de ces cellules ainsi que ceux qui l'effacent, et finalement, comment ces processus influencent la plasticité de cette population.
Pour découvrir les programmes régulant le destin cellulaire et la plasticité de cette population, nous combinons des cribles multi-omiques, des analyses bioinformatiques et des essais fonctionnels in vivo et in vitro pour identifier les gènes candidats et les éléments régulateurs contrôlant le remodelage de l'identité positionnelle des cellules des crêtes neurales crâniales.
L'ensemble de ces travaux permettra de comprendre les mécanismes moléculaires qui contrôlent le remodelage de l'identité positionnelle des cellules de crêtes neurales crâniales et aidera de concevoir comment ces processus pourraient être redéployés pour réguler la plasticité cellulaire afin de stimuler la régénération endogène.