Inhibition du récepteur tyrosine kinase ErbB2/HER2 : de la méningite bactérienne aux cancers humains
Responsable(s) de projet
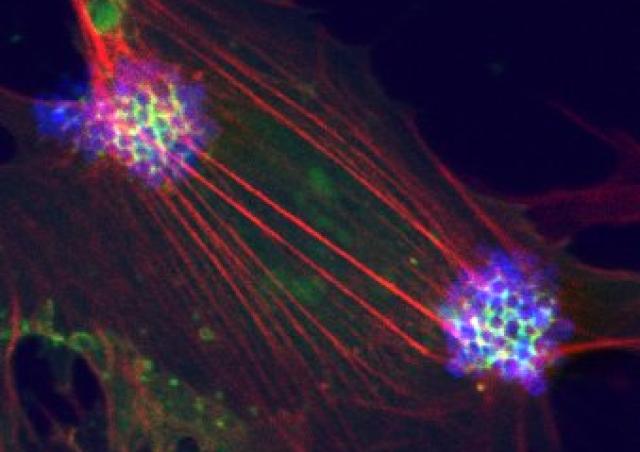
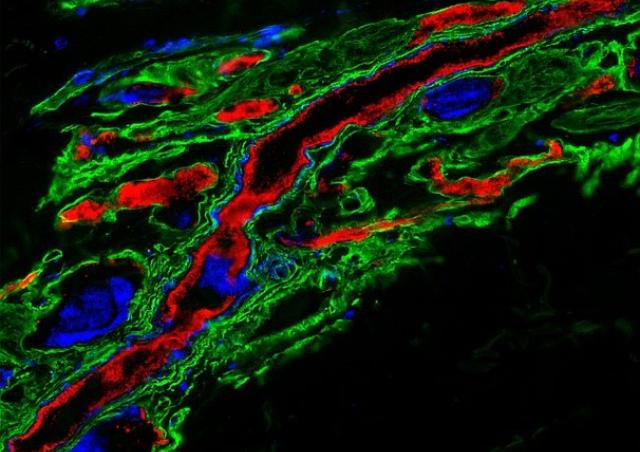
Parmi les récepteurs tyrosine kinase de la famille ErbB, ErbB2/HER2 présente des propriétés uniques. Ce récepteur orphelin existe naturellement dans une configuration activée, indépendante du ligand, qui favorise la transformation cellulaire lorsqu'il est surexprimé. De manière intrigante, cette structure ne conduit pas à l'activation d'ErbB2. Nous avons précédemment montré que l'infection des cellules endothéliales par N. meningitidis induit le recrutement sélectif et l’activation d'ErbB2 (1). Profitant de cette interaction hôte-pathogène qui constitue un outil unique pour étudier les mécanismes d'activation d'ErbB2, nous avons identifié une nouvelle protéine promouvant l'inhibition allostérique de l'activation ligand-indépendante d'ErbB2 (Brevet WO/2011/036211), et dont l’expression est réprimée dans les cancers du sein HER2+ (PCT/EP2018/079213). Sur la base de cette interaction, nous avons mis en place une méthode de criblage à haut débit (Brevet FR 14 52246) et identifié de nouvelles molécules inhibitrice de l’activité d’HER2 qui miment les effets du suppresseur allostérique (Brevet WO/2017/121755). Ces molécules, capables de traverser la barrière hémato-encéphalique, inhibent à la fois la progression du cancer du sein humain surexprimant HER2 et la progression des tumeurs cérébrales (2).
Maintenant, nous visons à élucider les mécanismes de régulation de l'expression de l'inhibiteur allostérique dans les cancers du sein HER2+ en mettant l'accent sur le rôle des miRNA, régulateurs clés de l'expression génique souvent dérégulés dans les cancers. Nous avons identifié des miARN clés représentant de bons biomarqueurs de diagnostic et de pronostic pour les cancers du sein HER2+ (brevet PCT/EP2018/079215) et montré que leur inhibition peut réprimer efficacement l'activation/expression de HER2 dans les tumeurs du cancer du sein (brevet PCT/EP2018/079212). Notre objectif actuel est d'identifier les cibles directes de ces miRs, qui contribuent à ces effets inhibiteurs. Ces approches représentent des stratégies complémentaires innovantes pour les thérapies du cancer du sein HER2+.
1. (Hoffmann et al., J Cell Biol 2001) 2. (Faure et al., Cancer Res 2021).