Membres du projet
Projet
Streptococcus pyogenes, également connu sous le nom de streptocoque du groupe A (SGA), est un agent pathogène strictement humain à Gram positif responsable d’environ 517 000 morts par an dans le monde. SGA induit des manifestations cliniques diverses, allant d’infections non invasives bénignes, tels qu’impétigo et pharyngite, aux infections invasives beaucoup plus sévères, tels que septicémie, fasciite nécrosante, endométrite, ou syndrome du choc toxique streptococcique. Ces infections sont insidieuses du fait que ces atteintes cliniques répétées peuvent conduire à des séquelles post-streptococciques mortelles. Il n'existe actuellement aucun vaccin contre le SGA. Les antibiotiques anti-SGA utilisés sont à large spectre.
La variété des infections causées par SGA est liée au fait que parmi les nombreux facteurs de virulence impliqués dans différents aspects de l’interaction avec les tissus de l'hôte ou de la résistance au système immunitaire, certains sont limités à quelques souches. En effet, les souches de SGA sont génétiquement très diverses. Elles sont classées par génotypage (emm type) et plus de 200 emm-types ont été identifiés. Il existe un lien entre génotype et répertoire des facteurs de virulence et ainsi avec le tropisme tissulaire. Le génotype emm28, prévalent en Europe et Amérique du Nord, est associé aux infections gynéco-obstétricales. En France, celles-ci représentent 60% des infections invasives à SGA chez les femmes en âge de procréer.
Nous nous intéressons plus particulièrement aux premières étapes des infections à SGA, correspondant à l’adhésion au tissu, la croissance bactérienne et l’invasion du tissu, avec l’endométrite comme modèle d’étude. Nous utilisons un isolat clinique emm28 issu d’une endométrite et génétiquement et phénotypiquement représentatif des souches emm28.
Bases moléculaires de la colonisation et de l’invasion de tissus humains par SGA
Le projet se décompose en deux axes principaux. Dans le premier axe, nous analysons l’interaction de SGA avec la décidue, tissu qui tapisse l’endomètre en fin de grossesse. Elle est composée de cellules stromales, se différenciant en cellules déciduales au cours du cycle menstruel, et de cellules immunitaires, variant au cours de la grossesse. Elle est la cible de la nidation mais également des infections endométriales. Dans le deuxième axe, nous étudions le lien entre métabolisme des acides gras et virulence de SGA.
Interaction SGA – décidue
Les souches emm28 présentent à leur surface une adhésine qui leur est spécifique, R28. De façon originale pour une adhésine de SGA, R28 fixe directement des intégrines et, de fait, des intégrines fixant la laminine, protéine très présente au niveau utérin. La délétion de R28 conduit à une diminution de l’adhésion de SGA aux cellules déciduales stromales primaires. R28 favorise également l’adhésion de SGA aux cellules épithéliales, endométriales, pulmonaires et kératinocytes. Ceci peut rendre compte de la prévalence du génotype emm28.
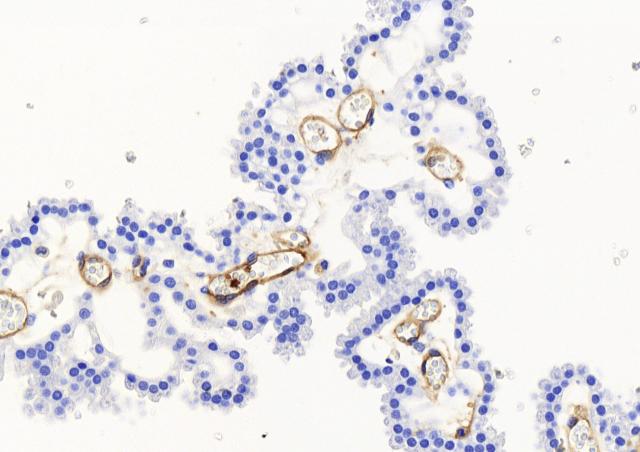
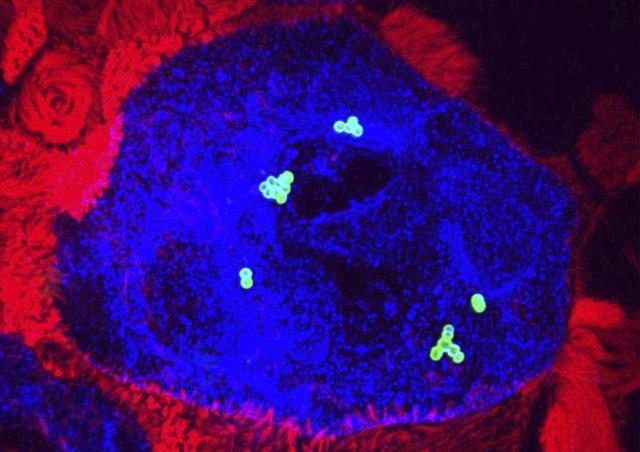
Une analyse holistique de l’infection ex vivo du tissu décidual humain par SGA a été menée. La décidue est préparée à partir de membranes foeto-maternelles obtenues après consentement de la mère. L’étude, qui impliquait de l’imagerie sur matériel fixé et en temps réel, les outils d’analyse d’image, des quantifications d’ARN et de protéines, a permis de caractériser pour la première fois les étapes initiales de infections invasives à SGA. SGA adhère au tissu puis se multiplie à sa surface dans les trois dimensions, environ 107 fois en 24 heures, grâce à des produits sécrétés par les cellules du tissu. SGA l’envahit et induit la mort de cellules déciduales stromales et immunitaires. SGA altère la réponse immunitaire, la limitant à la réponse immunitaire innée immédiate. Deux facteurs majeurs de virulence de SGA, la cystéine protéase SpeB et l’hemolysine Streptolysine O interviennent dans ces divers processus. Ceci rend compte de l’efficacité de SGA à induire des fièvres puerpérales.

Métabolisme des acides gras et virulence de SGA
Afin de déchiffrer les mécanismes mis en jeu par SGA pour envahir les tissus, nous nous appuyons sur un résultat publié par d’autres équipes. Les souches déficientes dans le répresseur transcriptionnel de la voie de biosynthèse des acides gras (FASII), FabT, présentent une virulence atténuée. En outre, ces souches disséminent beaucoup moins bien, environ 200 fois, que la souche sauvage. Notre hypothèse est que la dérégulation des gènes FASII conduit à des défauts de la composition en acides gras de la membrane. Ceux-ci altèreraient la mise en place de protéines de surface, membranaires ou pariétales. L’ensemble de ces modifications interférerait avec la capacité d’adaptation de SGA à son environnement.
Par analyse des profils transcriptomiques des souches cultivées dans des conditions variées, nous avons défini le régulon FabT. Un seul gène autre que les gènes FASII est co-régulé avec ceux-ci. Nous avons établi les modifications de composition en acide gras des souches sauvage et mutée. Une analyse lipidomique montre que le mutant présente un défaut dans des lipides intervenant notamment dans la mise en place d’éléments de surface bactérien. Par approche protéomique, nous avons confirmé que des protéines de surface sont en quantité différente chez les souches sauvage et mutée. Par des approches telles que celles menées lors de l’étude de l’interaction de SGA avec la décidue, nous caractérisons les modifications physiologiques induites par la mutation de FabT. Ainsi, nous déterminerons les causes du défaut de virulence des souches ne contrôlant pas l’expression des gènes de la voie de biosynthèse des acides gras. A long terme, la compréhension du rôle de FabT dans la virulence permettra d’utiliser FabT ou des protéines mise en évidence dans le mutant comme cibles d’antibactériens spécifiques.