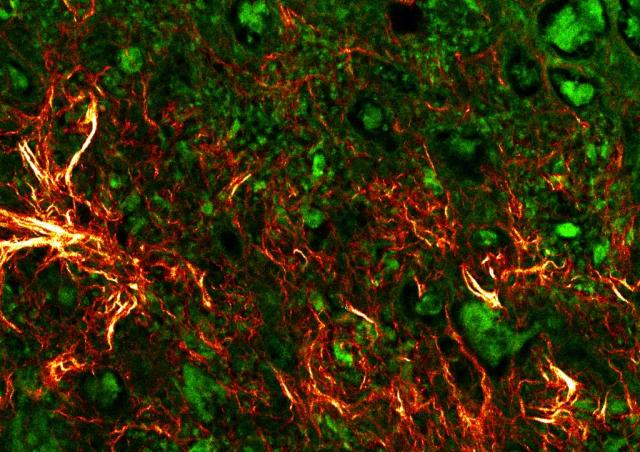
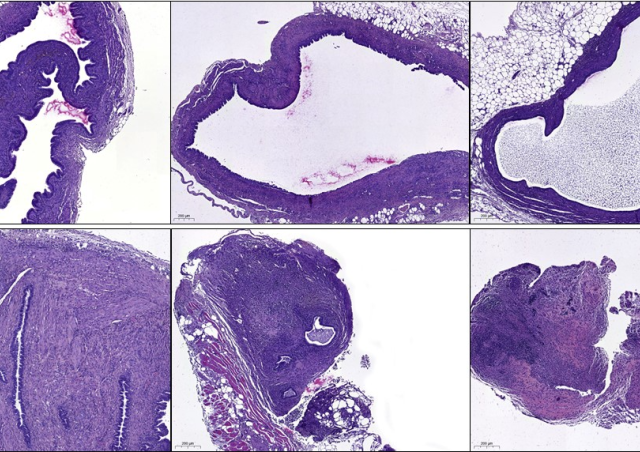
La polyarthrite rhumatoïde (PR) est le rhumatisme inflammatoire chronique le plus fréquent. ll s’agit d’une maladie auto-immune à tropisme articulaire caractérisée par une inflammation chronique du tissu synovial appelée synovite. La synovite est responsable de douleurs et de gonflements articulaires qui touchent principalement les petites articulations, notamment les mains et les pieds. L’inflammation chronique synoviale conduit secondairement à des destructions du cartilage et de l’os sous-chondral. Ces destructions aboutissent à terme à des déformations articulaires à l’origine d’un handicap fonctionnel. Il est donc indispensable de débuter le traitement de la PR le plus tôt possible afin de prévenir l’apparition de ces dégâts structuraux. Les traitements actuels ciblent l’inflammation synoviale et systémique. Malgré ces progrès, environ un tiers des patients restent réfractaires à ces différentes biothérapies, du fait d’un échec primaire, ou du développement d’une résistance au traitement. Cette situation impose donc d’étudier de nouvelles pistes thérapeutiques. La membrane synoviale est le tissu cible de la PR et le premier site du processus inflammatoire conduisant à la formation d’un pannus composé de synoviocytes, de cellules inflammatoires et de nombreux néovaisseaux. Notre objectif est d’identifier de nouveaux acteurs de l’angiogenèse et de l’inflammation synoviale afin de développer des biomarqueurs performants de l’activité ou de la sévérité de la PR ainsi que des approches thérapeutiques innovantes.
Membres du projet
Projet
Notre objectif est d’identifier par des approches non biaisées de nouveaux acteurs de l’angiogenèse et de l’inflammation synoviale. L’expression des cibles d’intérêt est ensuite étudiée dans les cellules endothéliales, les synoviocytes, le sérum, le liquide articulaire et le tissu synovial des patients. Nous avons à cet effet constitué une grande banque d’échantillons biologiques. L’expression ou l’activité de ces cibles est ensuite modulée par différentes approches afin d’étudier leurs effets sur les propriétés fonctionnelles des cellules endothéliales, des cellules immunes ou des synoviocytes. L’effet de la modulation de l’expression ou de l’activité des différentes cibles d’intérêt est ensuite étudiée in vivo dans des modèles murins de néoangiogenèse et d’arthrite expérimentale. Nous travaillons en étroite collaboration avec les équipes cliniques de l’hôpital Cochin afin que nos recherches puissent bénéficier autant que possible aux patients.